Исследование получено: 26 апреля 2018 года и принято: 16 июля 2018 года.
Опубликовано онлайн: 09 августа 2018 г.
Nilambra Dogra1,2, Ashok Kumar1,3 & Tapas Mukhopadhyay1
1 — Национальный центр изучения и исследования генома человека, Университет Панджаб, Сектор-14, Чандигарх, 160014, Индия. 2 — Настоящий адрес: Кафедра экспериментальной медицины и биотехнологии, Институт последипломного медицинского образования и исследований, Сектор-12, Чандигарх, 160012, Индия. 3 — Настоящий адрес: Центр системной биологии и биоинформатики, Университет Панджаб, Сектор-25, Чандигарх, 160014, Индия. За перепиской и просьбами о предоставлении материалов следует обращаться к Т.М. (e-mail: [email protected]).
Препараты, которые уже клинически одобрены или экспериментально испытаны для лечения заболеваний, отличных от рака, но обладают ранее не признанной цитотоксичностью в отношении злокачественных клеток, могут служить подходящими противораковыми кандидатами. Метил N-(6-фенилсульфанил-1H бензимидазол-2-ил) карбамат [фенбендазол, FZ], соединение бензимидазола, является безопасным и недорогим антгельминтиком, обладающим эффективной антипролиферативной активностью.
В нашей предыдущей работе мы сообщали о мощной ингибирующей рост активности FZ, частично вызванной нарушением протеасомной функции. Здесь мы показываем, что FZ демонстрирует умеренное сродство к тубулину млекопитающих и проявляет цитотоксичность к раковым клеткам человека в микромолярных концентрациях. Одновременно он вызывал митохондриальную транслокацию p53 и эффективно ингибировал поглощение глюкозы, экспрессию транспортеров GLUT, а также гексокиназу (HK II) — ключевой гликолитический фермент, которым питается большинство раковых клеток. Он блокировал рост человеческих ксенотрансплантатов в мышиной модели nu/nu, когда мышей кормили препаратом перорально.
Полученные результаты, в сочетании с нашими предыдущими данными, позволяют предположить, что FZ является новым агентом, вмешивающимся в микротрубочки, который проявляет антинеопластическую активность и может быть оценен как потенциальный терапевтический агент благодаря своему воздействию на многочисленные клеточные пути, ведущие к эффективному уничтожению раковых клеток.
Важность микротрубочек в делении клеток, их подвижности, внутриклеточной транспортировке и их роль в модуляции клеточной формы в зависимости от окружающей среды сделали их одной из наиболее успешных мишеней противораковой терапии. Агенты, нарушающие динамику микротрубочек, широко используются в лечении рака1-4. Учитывая относительный успех митотических агентов в лечении рака, микротрубочки можно назвать одной из лучших мишеней для лечения рака, выявленных до сих пор5.
Препараты, нацеленные на микротрубочки, можно разделить на два основных класса. Первый класс состоит из дестабилизирующих микротрубочки агентов, которые ингибируют полимеризацию микротрубочек. Этот класс антимитотических препаратов включает несколько соединений, таких как алкалоиды винки (винбластин, винкристин, винорелбин, виндезин, винфлунин), эстрамустин, колхицин и комбрестатины, которые используются в клинической практике или находятся в стадии клинических исследований для лечения рака. Второй класс составляют агенты, стабилизирующие микротрубочки. К ним относятся паклитаксел, доцетаксел, эпотилоны и дискодермолид6.
Следствием нарушения динамики тубулина и микротрубочек обоими этими классами препаратов в делящихся клетках является остановка метафазы и индукция апоптоза.
Фенбендазол (метил N-(6-фенилсульфанил-1H-бензимидазол-2-ил) карбамат) — бензимидазольный антгельминтик широкого спектра действия, разрешенный к применению у многих видов животных7. Повторное использование ветеринарных препаратов, показавших многообещающие результаты, для применения у людей может привести к значительному сокращению времени и затрат на разработку новых препаратов. Известно, что фенбендазол имеет высокий запас прочности, и большинство видов животных переносят его очень хорошо. Он обладает очень низкой степенью токсичности и высокой степенью безопасности у экспериментальных животных8-12.
В данном исследовании мы показали, что фенбендазол FZ) проявляет умеренную деполимеризующую активность микротрубочек в отношении раковых клеток человека, но обладает мощным противоопухолевым эффектом, что подтверждается экспериментами in vitro и in vivo. Наши результаты показывают, что FZ оказывает противоопухолевое действие через нарушение динамики микротрубочек, активацию p53 и модуляцию генов, участвующих в многочисленных клеточных путях. Лечение FZ также привело к снижению поглощения глюкозы в раковых клетках из-за снижения регуляции GLUT-транспортеров и ключевых гликолитических ферментов.
Поскольку в процессе опухолеобразования участвует целый ряд генов и белков, изменяющих различные клеточные сигнальные пути, препараты с одной мишенью показывают ограниченную эффективность и могут привести к лекарственной устойчивости13-15. Поэтому ожидается, что агенты с несколькими клеточными мишенями будут обладать повышенной эффективностью, а также смогут избежать вероятности развития резистентности. В целом, настоящая работа демонстрирует плейотропное действие FZ на раковые клетки, приводящее к их гибели. Таким образом, FZ может иметь потенциальное терапевтическое применение.
Результаты
FZ дестабилизирует тубулиновую сеть в клетках NSCLC человека.
Сообщалось, что бензимидазолкарбаматы ингибируют полимеризацию тубулина и нарушают функцию микротрубочек в клетках паразитов16,17. Результаты исследований in vitro с использованием обогащенных экстрактов тубулина гельминтов и млекопитающих позволили предположить, что тубулин является основной молекулярной мишенью бензимидазолов18.
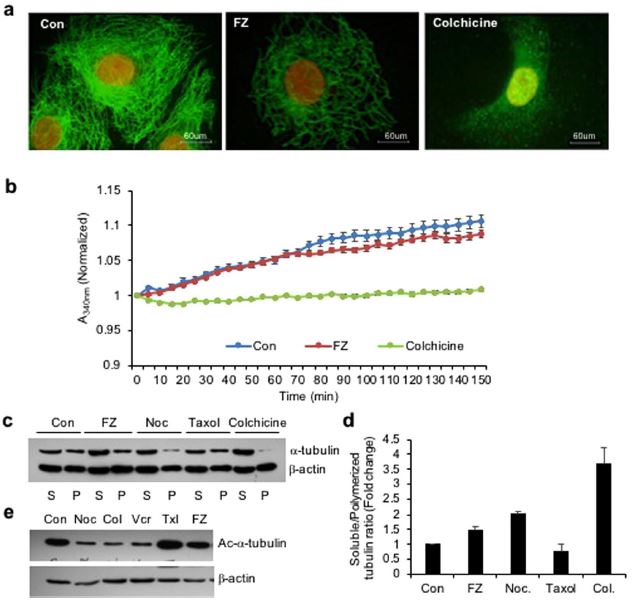
Поэтому для изучения влияния FZ на организацию микротрубочковой сети млекопитающих клетки человеческой немелкоклеточной карциномы легких (NSCLC) A549 обрабатывали 1 мкМ FZ в течение 24 ч и обрабатывали для иммунофлуоресценции с использованием антитела к α-тубулину. Колхицин использовался в качестве положительного контроля. Результаты показали, что обработка FZ вызвала частичное изменение сети микротрубочек (рис. 1а). Клетка микротрубочек вокруг ядра, казалось, потеряла свою целостность по сравнению с контрольными клетками, обработанными муляжом. Однако это изменение в организации было не столь выраженным, как в случае лечения колхицином, которое показало полную деполимеризацию микротрубочек в тубулиновые субъединицы. Эти данные позволяют предположить, что FZ вызывает искажение микротрубочкового каркаса клеток.
Влияние FZ на полимеризацию тубулина было дополнительно оценено с помощью анализа in vitro. Очищенный бычий тубулин инкубировали с FZ, и полимеризацию тубулина регистрировали по времени. Результаты показали легкое ингибирование полимеризации тубулина FZ in vitro, которое было не таким выраженным, как в случае лечения колхицином. (рис. 1б)
Далее эффект FZ на полимеризацию тубулина сравнивался с эффектом других дестабилизирующих микротрубочки агентов, таких как нокодазол и колхицин. Полимеризованная и растворимая фракции были получены после 24-часовой обработки препаратом, и вестерн-блот был проведен с использованием антител к α-тубулину и β-актину (рис. 1c). Полосы тубулина в полимеризованной и растворимой фракциях были определены количественно после нормализации с соответствующими полосами β-актина, который служил в качестве внутреннего контроля (рис. 1d).
В клетках, обработанных FZ, наблюдалось умеренное снижение полимерного тубулина по сравнению с контрольными необработанными клетками, тогда как полимеризованная форма тубулина практически отсутствовала в клетках, обработанных колхицином. Результат подтверждает относительно мягкую деполимеризующую тубулин активность FZ по сравнению с другими известными агентами, разрушающими микротрубочки, такими как нокодазол и колхицин.
Основным ограничивающим фактором таксанов и алкалоидов винки является их токсичность, ограниченная дозой, и восприимчивость к множественной лекарственной устойчивости (МЛУ), возникающей обычно из-за высокой экспрессии p-гликопротеина (p-gp; MDR1)19,20. Известно, что сверхэкспрессия изоформ β-тубулина и мутации также обусловливают устойчивость к таксанам21.
В отличие от таксанов и алкалоидов винки, препараты, нацеленные на колхицин-связывающий сайт, имеют преимущество в том, что они демонстрируют минимальную множественную лекарственную устойчивость в дополнение к их способности преодолевать эффект сверхэкспрессии изоформ β-тубулина22-24. Однако основным недостатком колхицина и его производных является их острая токсичность для человека22,25. Поэтому ингибитор микротрубочек, который связывается с колхицин-связывающим сайтом, но обладает низкой токсичностью, может быть высокоэффективным26,27. Результаты конкурентного анализа связывания колхицина с флуоресценцией свидетельствуют о том, что FZ может связываться с тубулином в месте связывания колхицина (рис. S1).
Ацетилирование тубулина было связано со стабильностью микротрубочек. Поэтому для изучения состояния ацетилирования тубулина после лечения клетки NSCLC человека обрабатывали различными агентами, нацеленными на микротрубочки, в течение 24 ч, а клеточные экстракты подвергали вестерн-блот-анализу с использованием специфического антитела Ac-α-тубулин (6-11B-1). Как показано на рис. 1e, в то время как нокодазол, колхицин и винкристин приводили к заметному снижению ацетилированного тубулина, FZ не изменял количество ацетилированного тубулина по сравнению с контрольными клетками, обработанными макетами. Этот результат еще раз подтвердил относительно мягкое воздействие FZ на тубулин млекопитающих по сравнению с другими известными деполимеризующими микротрубочки агентами.
Рисунок 1. Лечение FZ изменяет тубулиновую сеть раковых клеток человека. (a) Клетки A549 обрабатывали 1 мкМ FZ или 50 нг/мл колхицина в течение 24 ч. После обработки клетки обрабатывали для иммунофлуоресценции с использованием анти α-тубулина первичного и конъюгированных с FITC вторичных антител. (Ядра окрашивали йодистым пропидием) (b) бычий тубулин (1,8 мг/мл) инкубировали с ДМСО (контроль), FZ (10 мкМ) или колхицином (100 нМ), и влияние на полимеризацию отслеживали спектрофотометрически, измеряя мутность при 340 нм, как описано в разделе «Методы». (c) Клетки обрабатывали FZ, нокодазолом, таксолом или колхицином в течение 24 ч, затем лизировали и фракционировали на растворимые (S) и полимеризованные (P) экстракты. Экстракты разделяли с помощью SDS-PAGE, переносили на PVDF мембраны и тестировали анти-α-тубулиновыми и анти-β-актиновыми антителами. Показан репрезентативный иммуноблот-анализ в клетках A549. (d) Интенсивность каждой полосы иммуноблота была измерена с помощью программы NIH ImageJ, и были рассчитаны соотношения растворимого и полимеризованного тубулина и β-актина в каждой обработке. (e) Клетки обрабатывали различными МТА, как указано, в течение 24 ч, после чего проводили вестерн-блоттинг с использованием специфических антител к Ac-α-тубулину (6-11B-1) и β-актину. (Полноразмерные необрезанные блоты включены в Дополнительный рис. S6).
FZ не является субстратом или ингибитором P-gp.
Развитие лекарственной устойчивости является одной из основных проблем в лечении рака. Множественная лекарственная устойчивость (МЛУ), вызванная сверхэкспрессией гена MDR-1, кодирующего P-гликопротеин (P-gp), является важнейшим механизмом лекарственной устойчивости, который приводит к перекрестной устойчивости к нескольким классам препаратов28,29.
Большое количество широко используемых химиотерапевтических препаратов, таких как таксаны и алкалоиды винки, являются субстратами P-gp30.
Однако попытки ингибировать P-gp не дали обнадеживающих результатов из-за неизбежных побочных эффектов31,32. Поэтому открытие и разработка новых антипролиферативных соединений, которые не являются субстратами P-gp, является эффективным подходом для преодоления лекарственной устойчивости. Чтобы проверить, является ли FZ субстратом или ингибитором P-gp, мы исследовали ингибирование роста раковых клеток FZ в присутствии ингибитора P-gp верапамила. Результаты показали, что ингибирование P-gp верапамилом не усиливало ингибирующий эффект FZ на пролиферацию раковых клеток (рис. 2c). Флуоресцентный краситель родамин 123 (Rho123) является хорошо известным эталонным субстратом P-gp, часто используемым для определения ингибирующего потенциала P-gp препаратов33.
Не наблюдалось существенной разницы в накоплении Rho123 между контрольными необработанными и обработанными FZ клетками, что означает отсутствие какого-либо взаимодействия FZ с P-gp. (рис. 2a,b) В присутствии верапамила обработанные и необработанные клетки показали сопоставимые уровни накопления Rho123, что подтверждает, что FZ не является субстратом или ингибитором P-gp.