Il Dr. Gregory Riggins, professore di neurochirurgia e oncologia alla Johns Hopkins, e il suo gruppo di ricerca di solito incontrano poche o nessuna difficoltà nel consentire la crescita del cancro nei topi da laboratorio per i loro studi.
Tuttavia, nel 2009, per un periodo di alcuni mesi, in un gruppo di questi topi lo sviluppo del tumore non si è verificato. Dopo un ulteriore esame, hanno scoperto che questo risultato inaspettato era dovuto alla somministrazione a questi roditori di fenbendazolo come trattamento antiparassitario.
“Nella nostra esplorazione di vari farmaci all’interno di questo particolare gruppo, il fenbendazolo è emerso come il più efficace. Questo ha attirato la nostra attenzione”. Ha detto il ricercatore
Quando le notizie sulle sue capacità iniziarono a diffondersi, si scoprì che il fenbendazolo poteva essere somministrato da solo o in combinazione con altre procedure per curare o ostacolare la crescita del cancro.
Riggins e Gallia, insieme al loro gruppo di ricerca, hanno avviato un progetto non solo per comprendere il funzionamento di questo farmaco, ma anche per migliorarne l’utilità contro le cellule di glioblastoma e produrlo per la sperimentazione sui pazienti. Secondo la convinzione di questi ricercatori, il fenbendazolo aiuta a bloccare lo sviluppo del tumore limitando la formazione dei filamenti di tubulina, proteine vitali per la proliferazione delle cellule cancerose.
Questo evento si è verificato più di dieci anni fa. Oggi, con il passare del tempo, abbiamo acquisito conoscenze sostanziali sull’impiego efficace del fenbendazolo per aumentare le probabilità di debellare il cancro.
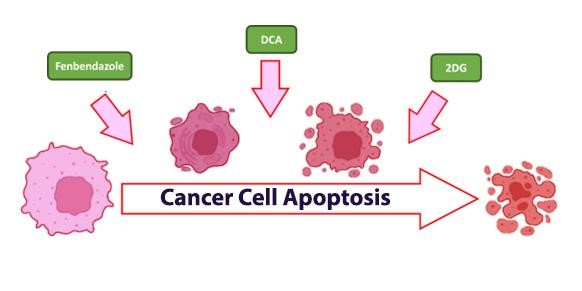
I farmaci rinnovati stanno facendo passi da gigante nel trattamento del cancro. Comprendendo come le cellule tumorali utilizzano l’energia, vediamo come composti come il fenbendazolo, il DCA (dicloroacetato di sodio) e il 2DG (2-deossi-D-glucosio) rivoluzionano i trattamenti standard come la chemio e le radiazioni, offrendo nuove speranze nella cura del cancro.
La struttura energetica del cancro
Nel 1923, Otto Heinrich Warburg – biochimico tedesco di importanza fondamentale, medico praticante e vincitore del Premio Nobel – rivelò una scoperta preziosa che ebbe un ruolo fondamentale nella comprensione del modello di metabolismo energetico delle cellule tumorali. Questo particolare fenomeno osservato è attualmente riconosciuto come la caratteristica chiave del cancro, più comunemente chiamata “Effetto Warburg”.
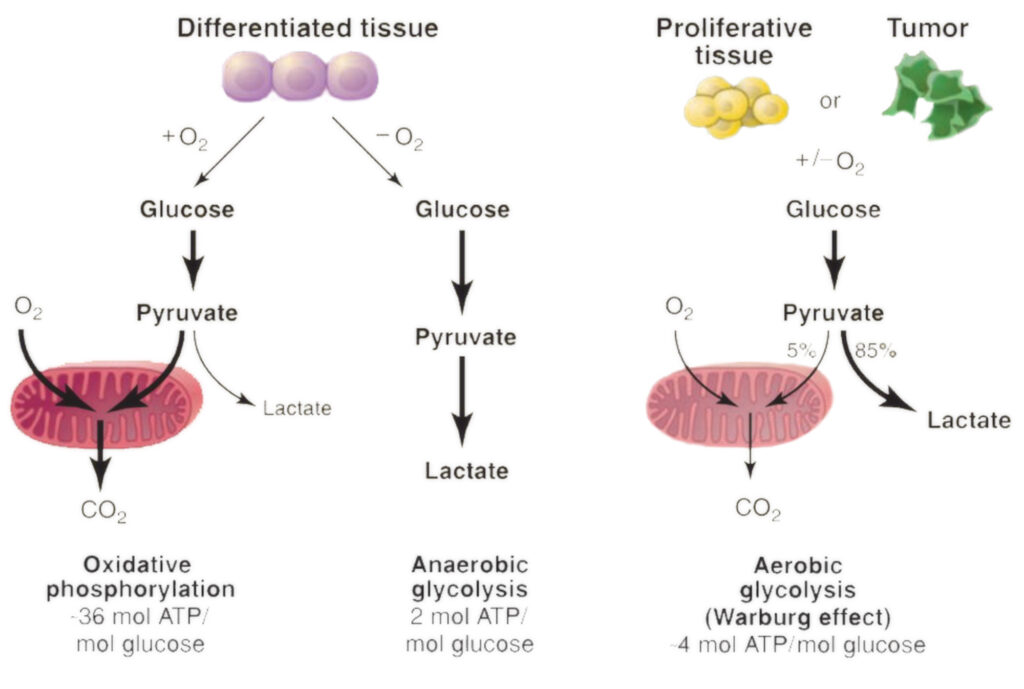
Un’osservazione degna di nota fatta da Warburg durante lo studio delle cellule tumorali di ratto: egli notò che esse prosperavano con livelli eccezionalmente elevati di glucosio (zucchero), invece di aumentare l’uso dell’ossigeno per la crescita, il che appariva controintuitivo, dato che l’estrazione di energia dai nutrienti attraverso tassi di utilizzo più elevati dell’ossigeno sarebbe stato un processo ampiamente efficiente.
L’accertamento di tali scoperte in quel periodo, circa cento anni fa, ha scatenato una curiosità sostanziale che ha portato a domande senza risposta rispetto alle soluzioni disponibili.
Il grande desiderio di glucosio e la diminuzione del consumo di ossigeno conferiscono alle cellule tumorali una serie di vantaggi evolutivi distinti. Un modo in cui l’impatto di Warburg aiuta le cellule maligne è quello di facilitare un rapido accumulo di biomassa. L’aumento dell’assorbimento di glucosio fornisce al tessuto tumorale un eccesso di elementi costitutivi per creare nuovo materiale genetico e proteine, portando così a un aumento della proliferazione e dell’espansione del cancro.
Inoltre, non è un segreto che le cellule normali dei mammiferi necessitino di un flusso costante di ossigeno, pena la loro rapida scomparsa. Tuttavia, le loro controparti malate si comportano in modo del tutto diverso: i tumori crescono rapidamente, spesso superando le scorte di O2 disponibili, ma non rallentano grazie alla loro natura adattativa; anzi, prosperano in queste circostanze senza soffocare.
In breve tempo, le cellule cancerose passano al processo metabolico della glicolisi dipendente dall’ossigeno. Iniziano a generare e scaricare abbondanti quantità di acido lattico oltre i confini cellulari, causando di conseguenza un aumento delle condizioni di acidità all’interno dell’ambiente tumorale.
L’aumento dell’acidità di questi ambienti cancerosi favorisce l’ulteriore penetrazione e diffusione degradando la matrice extracellulare che collega le cellule del nostro corpo. Quando questo livello di acidità aumenta, aiuta le crescite maligne a eludere il nostro meccanismo immunitario – una guardia intrinseca contro malattie come queste. È innegabile che questo sia uno dei motivi per cui l’immunoterapia tende spesso a perdere il suo impatto quando si lavora sugli stadi avanzati del cancro.
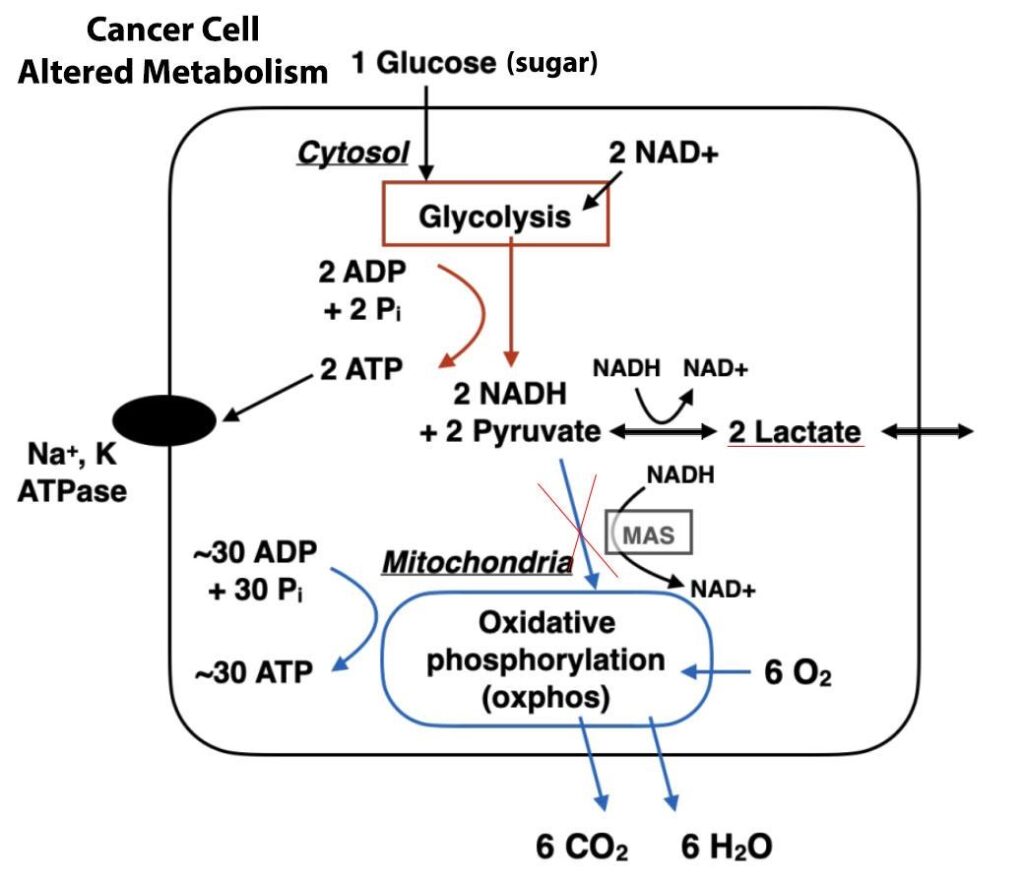
Contemporaneamente, le cellule cancerose assorbono meno ossigeno e i mitocondri al loro interno generano meno specie reattive dell’ossigeno. Queste funzionano in modo cruciale sia per arrestare che per eliminare le cellule cancerose dannose. La malattia inizia a schivare un meccanismo chiamato apoptosi.
L’apoptosi è un fenomeno ordinario che entra in gioco nel nostro corpo; elimina opportunamente le cellule indesiderate o in eccesso dal continuare la loro esistenza con l’anatomia.
Si tratta essenzialmente di una morte cellulare naturale e preordinata che arresta la crescita tumorale all’inizio, sterminando se stessa, soprattutto per prevenire qualsiasi potenziale espansione inutile di questi tumori all’interno di noi, causando danni irreparabili e rendendo così i corpi cellulari maligni privi di vita.
Si tratta di vantaggi metabolici fondamentali che consentono la progressione sregolata del ciclo di vita di varie trasformazioni, prosperando indefinitamente e diventando immortali grazie al deterrente della morte programmata tempestiva (apoptosi).
Un accenno significativo va fatto a questo processo evolutivo piuttosto contorto che le metamorfosi neoplastiche subiscono e che tende a sfidare i medici, rendendo questi disturbi avversari formidabili che richiedono protocolli di trattamento complessi, ma non dimentichiamo anche un altro aspetto, ossia lo sfruttamento dell’effetto Warburg contro le sostanze cancerogene.
Per quanto riguarda l’identificazione delle malattie, l’umanità ha utilizzato questo fenomeno del metabolismo del cancro a scopo di rilevamento. Il test noto come tomografia a emissione di positroni (PET) evidenzia i tessuti e gli organi con un’attività metabolica insolita.
Poiché le cellule cancerose presentano l’effetto Warburg, assorbono glucosio radioattivo a una velocità centinaia di volte superiore rispetto al tessuto standard che le circonda. Di conseguenza, i tumori si illuminano nelle immagini risultanti, consentendo una facile localizzazione in tutto il corpo.
Per quanto riguarda il trattamento, riconoscendo che quasi tutti i precedenti trattamenti antitumorali si sono concentrati esclusivamente su tecniche incentrate sui geni, il cambiamento di paradigma “Warburg” potrebbe essere considerato un “tallone d’Achille” trascurato in qualsiasi approccio mirato al trattamento dei tumori nell’arco di quasi un secolo. Un composto alternativo – il dicloroacetato di sodio (DCA) – agisce in modo unico, riportando all’equilibrio le funzioni cellulari anomale legate al metabolismo.
Necessità dell'immunoterapia
Le cellule tumorali hanno sviluppato diversi meccanismi per mimetizzarsi, rendendosi così impercettibili alle difese immunitarie del nostro organismo. Possono possedere mutazioni genetiche o presentare proteine di superficie distinte: entrambi i fattori possono impedire al sistema immunitario di riconoscere e combattere queste cellule.
Le TIL sono parte integrante di questo scenario. Se i tumori di un paziente non contengono queste TIL, significa che la risposta immunitaria difensiva non sta combattendo efficacemente contro il tumore maligno, rendendo necessario un intervento immunoterapeutico.
Difficoltà dell'immunoterapia del cancro
Il trattamento del cancro è entrato in una nuova fase con l’immunoterapia, portando ottimismo a molte persone. Tuttavia, questo approccio non è privo di complicazioni. Una delle principali preoccupazioni è la capacità delle cellule cancerose di sviluppare una tolleranza nel tempo. A causa della loro elevata produzione di energia attraverso il processo di glicolisi, queste cellule dannose spesso bloccano percorsi specifici importanti per gestire efficacemente le funzioni dei linfociti T.
Se queste cellule T non sono maturate in modo accurato, non riescono a identificare e neutralizzare efficacemente le cellule tumorali, che vengono invece promosse dalla forza acquisita dagli anticorpi terapeutici somministrati in precedenza.
Affrontare le difficoltà
In risposta a questi ostacoli, dirigere gli sforzi verso l’inibizione del sistema di produzione di energia delle cellule tumorali dopo l’immunoterapia potrebbe rivelarsi vantaggioso. Limitando la loro alimentazione, è possibile che non siano in grado di bloccare i percorsi di segnale che dettano lo sviluppo e il controllo delle cellule T.
Ultime scoperte negli studi scientifici: 2-deossi-D-glucosio (2DG)
Nel trattamento del cancro, in particolare del tumore al seno triplo negativo (TNBC), c’è uno sviluppo entusiasmante.
Gli scienziati hanno scoperto che la combinazione dell’immunoterapia con un antimetabolita del glucosio noto come 2DG potrebbe migliorare l’efficacia del trattamento. Questo è particolarmente degno di nota perché le cellule del TNBC spesso presentano livelli elevati di una proteina chiamata “legante di morte programmata 1” (PD-L1).
Per quanto riguarda il trattamento della TNBC, solo un piccolo gruppo di pazienti, all’incirca il 10-20%, ottiene risultati positivi dalle terapie che hanno come bersaglio PD-L1 o PD-1, attori chiave della risposta immunitaria dell’organismo.
Questo nuovo approccio, che prevede l’uso di 2DG, potrebbe potenzialmente cambiare le carte in tavola per molte pazienti affette da TNBC che attualmente hanno risposte limitate al trattamento.
Ecco un punto chiave: una particolare forma di PD-L1, nota come PD-L1 glicosilato, è cruciale per le interazioni che avvengono nell’ambito del binomio PD-L1-PD-1. Inoltre, le cellule associate al TNBC tendono ad avere livelli più elevati di PD-L1 glicosilato rispetto alle cellule non TNBC.
La ricerca ha dimostrato che, incidendo significativamente sulla stabilità e sulla funzione di questa molecola pro-cancro inibitrice del sistema immunitario, è possibile ridurre la quantità di glicosilazione su PD-L1.
È qui che entra in gioco il “deossiglucosio”. L’uso del deossiglucosio può potenzialmente interrompere questo processo, portando a nuove strategie che combinano diversi approcci per ottenere risultati più efficaci nel trattamento della TNBC.
Tecniche di trattamento del cancro: Metodi convenzionali e progressivi
Il viaggio verso soluzioni efficaci contro il cancro coinvolge numerosi metodi, che spaziano dalle tecniche convenzionali a quelle più all’avanguardia.
Le procedure di trattamento consolidate, come la chemioterapia e la radioterapia, sono ampiamente riconosciute, mentre elementi nuovi come il 2DG sono diventati progressivamente interessanti per i loro vantaggi prospettici nel trattamento del cancro, sia singolarmente che integrati con ausili consolidati come il fenbendazolo e il DCA, che contribuiscono anch’essi in modo significativo a combattere la malattia.

Chemioterapia
L’uso della chemioterapia è ancora un elemento fondamentale nella lotta contro la malattia nota come cancro. È particolarmente efficace per patologie come il cancro al seno, dove viene utilizzata per ridurre le dimensioni del tumore e facilitarne l’asportazione chirurgica – un approccio definito chemioterapia preoperatoria o PCT.
Tuttavia, anche se può ridurre le dimensioni del tumore, non possiamo sempre affidarci a questo metodo da solo, perché ci sono numerosi casi in cui le cellule maligne ricompaiono dopo il trattamento.
Potenziare l'impatto della chemioterapia con il 2DG
Gli studi indicano che l’associazione della chemioterapia con il 2DG può rafforzarne l’efficacia. Funzionalmente simile al glucosio, il 2DG è in grado di interferire con le attività metaboliche delle cellule tumorali e questo potrebbe potenzialmente aumentare l’impatto dei normali trattamenti chemioterapici.
Il duplice uso simboleggia il potenziale di una risposta patologica completa, che implica la possibilità di ottenere risultati di trattamento più forti e prolungati. A conferma di questa strategia combinata sono stati eseguiti numerosi test di laboratorio e studi su animali.
Terapia di radiazioni
All’interno delle cellule cancerose, il metodo indipendente per regolare il metabolismo degli zuccheri è il 2DG, ma viene anche fuso con forme terapeutiche come la chemioterapia e la radioterapia.
In termini realistici, la radioterapia svolge un ruolo cruciale nel trattamento del cancro. Circa il 60% delle persone che lottano contro questa crudele malattia subiranno questo tipo di trattamento, da solo o in combinazione con altri trattamenti.
La radioterapia, pur essendo uno strumento potente nella lotta contro il cancro, non è priva di sfide. È senza dubbio efficace, ma può avere effetti collaterali indesiderati nel tempo. Una delle preoccupazioni principali è che le cellule tumorali possano sviluppare una resistenza alle radiazioni, e c’è anche il rischio di danneggiare le cellule sane.
Per affrontare questi problemi, in particolare quello della tolleranza alle radiazioni, è fondamentale ricorrere agli inibitori glicolitici. Questi inibitori agiscono interrompendo l’apporto di energia alle cellule tumorali, privandole in sostanza dei nutrienti di cui hanno bisogno.
In questo modo è più difficile per le cellule tumorali ripararsi dopo essere state colpite dalle radiazioni, e ciò porta alla loro definitiva disgregazione e distruzione. Questo approccio rappresenta un passo avanti per rendere la radioterapia più sicura ed efficace per i pazienti.
Potenziamento della radioterapia mediante 2-Deossi-D-Glucosio
Il 2DG è un inibitore glicolitico. La sua funzione consiste nel legarsi alla proteina GLUT1, trasportatrice di glucosio, prima di essere fosforilata dall’enzima esochinasi. Tuttavia, la sua progressione metabolica termina qui, garantendo che la via glicolitica rimanga ostruita.
Pertanto, le cellule tumorali esposte a questo inibitore non riescono a produrre energia a causa dell’interruzione del normale processo di glicolisi del glucosio. Inoltre, il 2DG stimola le funzioni degli enzimi caspasi 3 e PARP che portano all’apoptosi delle cellule maligne, lasciando inalterate le cellule sane.
Nel trattamento del cancro, si prospetta una combinazione promettente: il 2-deossi-D-glucosio (2DG) abbinato alla radioterapia. Questo binomio potrebbe potenziare in modo significativo la potenza della radioterapia. Come?
Il 2DG agisce come inibitore del glucosio. Interferisce con la capacità delle cellule tumorali di ripararsi dopo essere state danneggiate dalle radiazioni, soprattutto perché queste cellule sono affamate di glucosio e di nutrienti essenziali.
Ma il 2DG non è solo un prodotto unico. Ha molteplici funzioni. Oltre a essere un perturbatore, amplifica anche l’impatto del trattamento con radiazioni. La sua azione è legata all’alterazione dell’equilibrio dei processi di ossidazione-riduzione all’interno delle cellule.
Un aspetto importante da sottolineare è che si ritiene che lo stress ossidativo sia un percorso chiave attraverso il quale le radiazioni ionizzanti uccidono le cellule tumorali. Questo nuovo approccio, che utilizza il 2DG in combinazione con la radioterapia, potrebbe cambiare le carte in tavola nel trattamento efficace del cancro.
Diversità delle cellule tumorali
Le cellule tumorali sono un gruppo eterogeneo, qualcosa che gli scienziati chiamano eterogeneità tumorale, ed è qualcosa che si trova in quasi tutti i tipi di cancro esistenti. Questa diversità spesso deriva da errori commessi durante il processo di replicazione del DNA quando le cellule si dividono.
Ecco cosa succede: Quando le cellule si dividono, se ci sono errori nella copia del loro DNA, nascono nuove cellule con mutazioni. Nel corso del tempo, soprattutto in presenza di determinati fattori ambientali che fungono da fattori scatenanti, queste cellule mutate possono evolvere e potenzialmente portare al cancro. È un processo lento, ma è così che molti tumori iniziano il loro percorso.
Varie forme di disparità nel cancro
La differenziazione osservata nelle cellule tumorali, definita eterogeneità tumorale, può essere semplicemente divisa in due parti:
Eterogeneità tumorale spaziale
Significa che le cellule tumorali non si diffondono uniformemente nel tessuto colpito. Al contrario, tendono a diffondersi in modo disordinato e imprevedibile.
Fluttuazioni temporali nella diversità tumorale
Quando i tumori si sviluppano nel tempo, spesso si evolvono in diversi sottotipi. Questo processo è noto come eterogeneità temporale. In sostanza, più a lungo un tumore cresce, più può diventare vario.
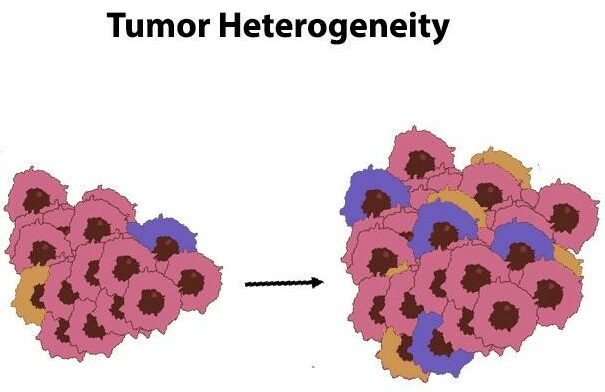
Le diverse caratteristiche delle cellule tumorali pongono ostacoli significativi quando si tratta di combattere efficacemente il cancro. La natura eterogenea di queste cellule maligne si traduce spesso in una resistenza alle attuali strategie terapeutiche.
Data la complessità del comportamento del cancro, è urgente sviluppare trattamenti in grado di colpire e superare efficacemente la resistenza causata dalla varia composizione genetica delle singole cellule tumorali.
Risultati della sperimentazione
Un’ampia gamma di studi, tra cui test di laboratorio, studi su animali e sperimentazioni cliniche sull’uomo, ha analizzato in profondità gli effetti del 2-deossi-D-glucosio (2DG) sulle cellule. Ciò che emerge da questa ricerca è che il 2DG agisce in modo complesso.
Non si limita a bloccare il processo di glicolisi cellulare, ma promuove anche l’apoptosi, o morte cellulare programmata, senza danneggiare le cellule sane. Inoltre, il 2DG influisce sul comportamento dei geni all’interno delle cellule.
Interrompe i fattori di trascrizione che sono fondamentali per attivare i geni essenziali per la replicazione cellulare. Questa intuizione indica il potenziale del 2DG come arma contro varie caratteristiche delle cellule tumorali.
Una cosa da notare delle cellule tumorali è la loro diversità di mutazioni genetiche, che giocano un ruolo nella progressione della malattia. Tuttavia, tutte tendono ad avere una cosa in comune: un tasso più elevato di metabolismo degli zuccheri rispetto alle cellule normali.
Ciò rende il 2DG un trattamento potenzialmente efficace per diversi tipi di cancro. Funziona affamando le cellule tumorali di zucchero e ossigeno e influenzando al contempo la loro attività genica. Questo approccio può rallentare la crescita delle cellule e indirizzarle verso l’autodistruzione, impedendo una crescita eccessiva.
Cura prospettica per il tumore del glioblastoma
Il glioblastoma è una forma particolarmente aggressiva di cancro al cervello, nota per la sua forte resistenza alla morte cellulare e per lo scarso successo dei trattamenti attuali. Questa situazione sottolinea l’urgente necessità di esplorare nuove opzioni terapeutiche.
Non molto tempo fa, il Dr. Evangelos Michelakis, un medico scienziato devoto, e il suo team hanno intrapreso diversi progetti di ricerca incentrati sulla terapia del Glioblastoma multiforme (GBM). Si sono resi conto che un trattamento ideale dovrebbe essere in grado di attraversare la barriera emato-encefalica e colpire le cellule tumorali in modo specifico, senza danneggiare i tessuti sani.
La loro scelta, il dicloroacetato di sodio (DCA), presentava queste qualità e, cosa più importante, non mostrava segni di danni al sangue, al cuore, ai reni o al fegato.
Questa scoperta li ha portati a condurre uno studio di riferimento su pazienti reali, aprendo la strada a ulteriori scoperte rivoluzionarie nel trattamento del GBM.
Impatto del DCA sulla demolizione delle cellule tumorali e sullo sviluppo del tumore
Sta diventando chiaro che il dicloroacetato (DCA) ha un impatto significativo sulla lotta contro il cancro, soprattutto nel caso del glioblastoma, una forma mortale di cancro al cervello. Il DCA è in grado di indurre la morte delle cellule tumorali, di ridurre i vasi sanguigni che alimentano i tumori e di rallentare la crescita di questo cancro aggressivo.
L’aspetto particolarmente promettente è che il DCA potrebbe essere più efficace se utilizzato insieme ad altri trattamenti, offrendo un nuovo raggio di speranza nella lotta a questa difficile malattia.
Insieme ad altre terapie per il glioblastoma
In una rara occasione, gli scienziati hanno avuto la possibilità di confrontare il tessuto cerebrale dei pazienti prima e dopo il trattamento con DCA. Il risultato è stato incoraggiante: una riduzione delle cellule tumorali nel tessuto cerebrale dopo il trattamento.
Ciò è stato attribuito a un aumento della distruzione delle cellule mortali e a una diminuzione della crescita delle cellule maligne del glioblastoma multiforme. La ricerca ha concluso che la combinazione del DCA con altri trattamenti potrebbe essere una strategia efficace contro il GBM.
Il team di ricerca suggerisce di utilizzare il dicloroacetato, noto per essere non tossico, prima o dopo procedure come la radioterapia o la chirurgia. Questo approccio potrebbe potenzialmente aumentare i benefici dei trattamenti standard per il GBM.