Gregory Riggins, professeur de neurochirurgie et d’oncologie à Johns Hopkins, et son groupe de recherche ne rencontrent généralement que peu ou pas de difficultés à permettre la croissance du cancer chez les souris de test pour leurs études.
Cependant, en 2009, sur une période de plusieurs mois, un groupe de ces souris n’a tout simplement pas développé de tumeur. Après un examen plus approfondi, les chercheurs ont découvert que ce résultat inattendu était dû au fait que ces rongeurs avaient reçu du fenbendazole comme traitement antiparasitaire.
« Lors de notre exploration de divers médicaments au sein de ce groupe particulier, le fenbendazole s’est avéré être le plus efficace. Cela a attiré notre attention ». a déclaré le chercheur
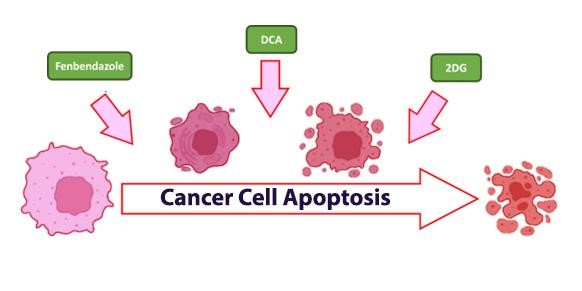
Au fur et à mesure que la nouvelle se répandait sur ses capacités, les individus ont découvert que le fenbendazole pouvait être administré seul ou combiné à d’autres procédures pour guérir ou entraver la croissance du cancer.
Riggins et Gallia, avec leur équipe de recherche, ont mis en place un projet visant non seulement à comprendre le fonctionnement de ce médicament, mais aussi à améliorer son utilité contre les cellules de glioblastome et à le produire en vue d’essais sur des patients. Selon le système de croyance de ces chercheurs, le fenbendazole aide à bloquer le développement des tumeurs en limitant la formation des brins de tubuline – des protéines vitales pour la prolifération des cellules cancéreuses.
Cet événement s’est produit il y a plus de dix ans. Aujourd’hui, avec le temps, nous avons acquis des connaissances substantielles sur l’utilisation efficace du fenbendazole pour améliorer nos chances d’éradiquer le cancer.
La structure énergétique du cancer
En 1923, Otto Heinrich Warburg, biochimiste allemand de premier plan, médecin praticien et lauréat du prix Nobel, a fait une découverte inestimable qui a joué un rôle majeur dans la compréhension du modèle de métabolisme énergétique des cellules cancéreuses. Ce phénomène particulier observé est actuellement reconnu comme la caractéristique clé du cancer, plus communément appelé « l’effet Warburg ».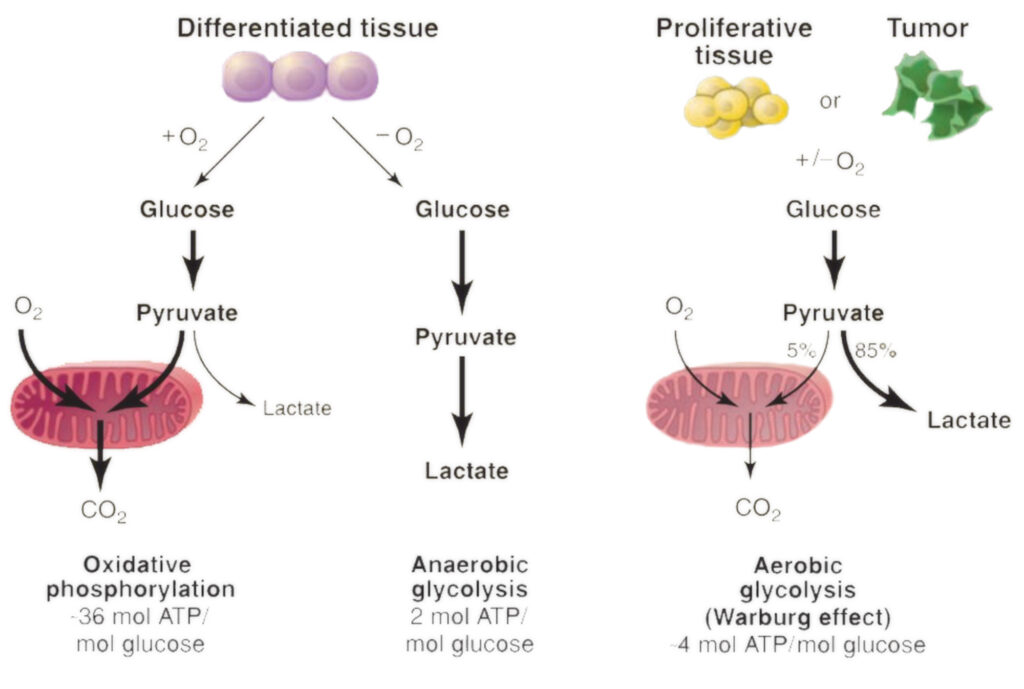
M. Warburg a fait une observation notable en étudiant des cellules tumorales de rats : il a remarqué qu’elles se développaient grâce à des niveaux exceptionnellement élevés de glucose (sucre) au lieu d’utiliser davantage d’oxygène à des fins de croissance, ce qui semblait contre-intuitif étant donné que l’extraction d’énergie à partir de nutriments via des taux d’utilisation plus élevés de l’oxygène aurait été un processus largement efficace.
L’établissement de telles découvertes à cette époque, il y a une centaine d’années, a suscité une grande curiosité qui a conduit à des questions restées sans réponse par rapport aux solutions disponibles.
L’énorme besoin de glucose et la diminution de la consommation d’oxygène confèrent aux cellules cancéreuses un ensemble distinct d’avantages évolutifs. L’une des façons dont l’impact Warburg aide les cellules malignes est de faciliter l’accumulation rapide de biomasse. L’amélioration de l’absorption du glucose permet aux tissus tumoraux de disposer de blocs de construction excédentaires pour créer du nouveau matériel génétique et des protéines, ce qui entraîne une augmentation de la prolifération et de l’expansion du cancer.
En outre, ce n’est un secret pour personne que les cellules normales des mammifères ont besoin d’un flux constant d’oxygène, faute de quoi elles meurent rapidement. Cependant, leurs homologues malades se comportent tout à fait différemment : la croissance rapide des tumeurs dépasse souvent la quantité d’oxygène disponible, mais elle ne ralentit pas en raison de sa nature adaptative ; au contraire, elle prospère dans de telles circonstances sans suffoquer.
Peu de temps après, les cellules cancéreuses transforment leur processus métabolique en glycolyse dépendante de l’oxygène. Elles commencent à générer et à rejeter d’abondantes quantités d’acide lactique au-delà des limites cellulaires, provoquant ainsi une augmentation des conditions acides dans l’environnement de la tumeur.
L’acidité accrue de ces environnements cancéreux favorise la pénétration et la propagation en dégradant la matrice extracellulaire qui relie les cellules de notre corps. Lorsque ce niveau d’acidité augmente, il aide les tumeurs malignes à échapper à notre mécanisme immunitaire – une protection inhérente contre les maladies de ce type. C’est indéniablement l’une des raisons pour lesquelles l’immunothérapie a souvent tendance à perdre de son impact lorsqu’elle est utilisée à des stades avancés du cancer.
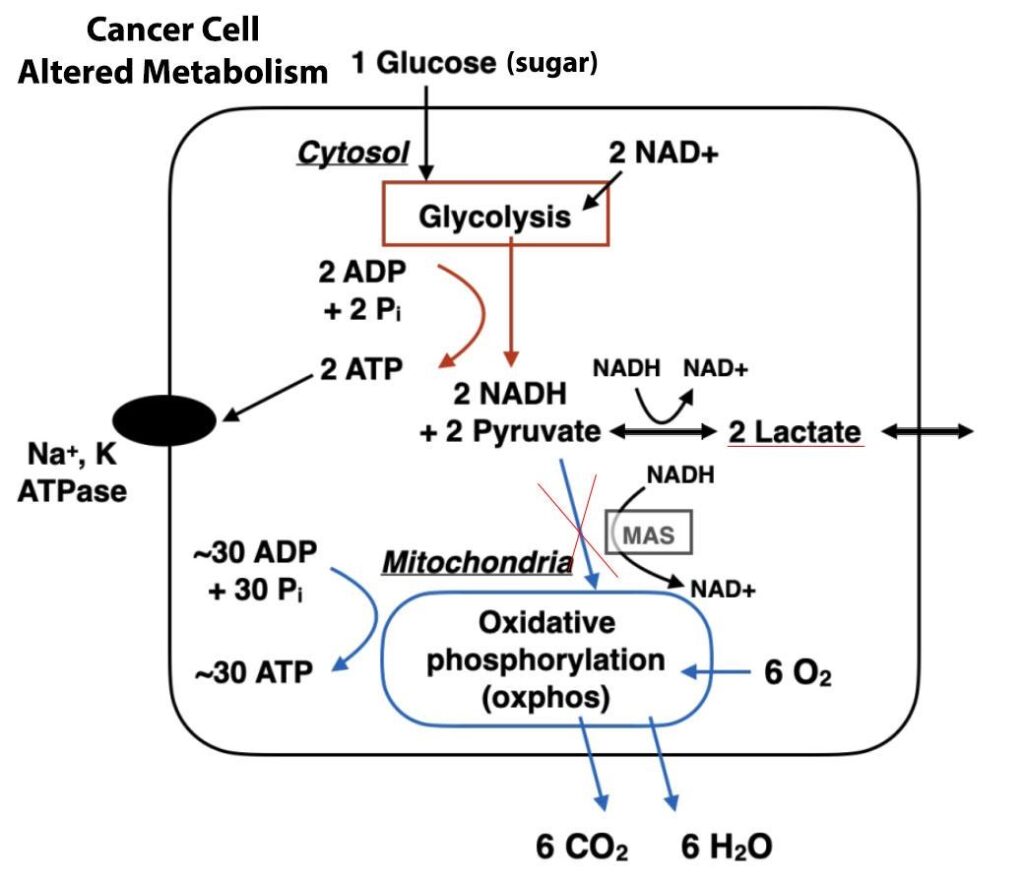
Simultanément, les cellules cancéreuses consomment moins d’oxygène, ce qui fait que les mitochondries qui les composent génèrent moins d’espèces réactives de l’oxygène. Celles-ci jouent un rôle crucial dans l’arrêt et la suppression des cellules cancéreuses nocives. La maladie commence à échapper à un mécanisme appelé apoptose.
L’apoptose est un phénomène ordinaire qui entre en jeu dans notre corps ; elle élimine commodément les cellules indésirables ou excessives de la poursuite de leur existence dans l’anatomie.
Il s’agit essentiellement d’une mort cellulaire naturelle préétablie qui arrête la croissance des tumeurs dès le début en s’exterminant elle-même, principalement pour empêcher toute expansion inutile potentielle de ces tumeurs à l’intérieur de nous, causant des dommages irréparables, rendant ainsi les corps cellulaires malins incessants.
Il s’agit là d’avantages métaboliques clés permettant une progression non régulée du cycle de vie de diverses transformations tout en prospérant indéfiniment, étant immortel grâce à la dissuasion des morts programmées en temps voulu (apoptose).
Il convient de mentionner tout particulièrement ce processus d’évolution plutôt alambiqué que subissent les métamorphoses néoplasiques et qui tend à défier les praticiens, faisant de ces affections des adversaires redoutables exigeant des protocoles de traitement complexes, mais n’oublions pas non plus un autre aspect, à savoir l’exploitation de l’effet Warburg contre les substances cancérigènes.
En termes d’identification des maladies, l’humanité a utilisé cette occurrence du métabolisme du cancer à des fins de détection. Le test connu sous le nom de tomographie par émission de positons (TEP) met en évidence les tissus et les organes présentant une activité métabolique inhabituelle.
Comme les cellules cancéreuses présentent l’effet Warburg, elles absorbent le glucose radioactif à un taux des centaines de fois supérieur à celui des tissus standard qui les entourent. Par conséquent, les tumeurs sont illuminées sur les images obtenues, ce qui permet de les suivre facilement dans tout le corps.
En ce qui concerne le traitement, le fait de reconnaître que presque tous les traitements anticancéreux antérieurs se sont concentrés uniquement sur des techniques centrées sur les gènes pourrait faire en sorte que le changement de paradigme « Warburg » soit potentiellement considéré comme un « talon d’Achille » négligé dans toute approche visant à traiter les cancers sur une période de près d’un siècle. Un autre composé, le dichloroacétate de sodium (DCA), agit de manière unique en rétablissant l’équilibre des fonctions cellulaires anormales liées au métabolisme.
Nécessité de l'immunothérapie
Les cellules cancéreuses ont développé divers mécanismes pour se camoufler, ce qui les rend indétectables par les défenses immunitaires de notre organisme. Elles peuvent posséder des mutations génétiques ou présenter des protéines de surface distinctes – ces deux facteurs peuvent empêcher le système immunitaire de discerner et de combattre ces cellules.
C’est là que les TIL jouent un rôle essentiel dans ce scénario. Si les tumeurs d’un patient ne contiennent pas ces TIL, cela signifie que la réponse immunitaire défensive ne lutte pas efficacement contre la tumeur maligne, d’où la nécessité d’une intervention immunothérapeutique.
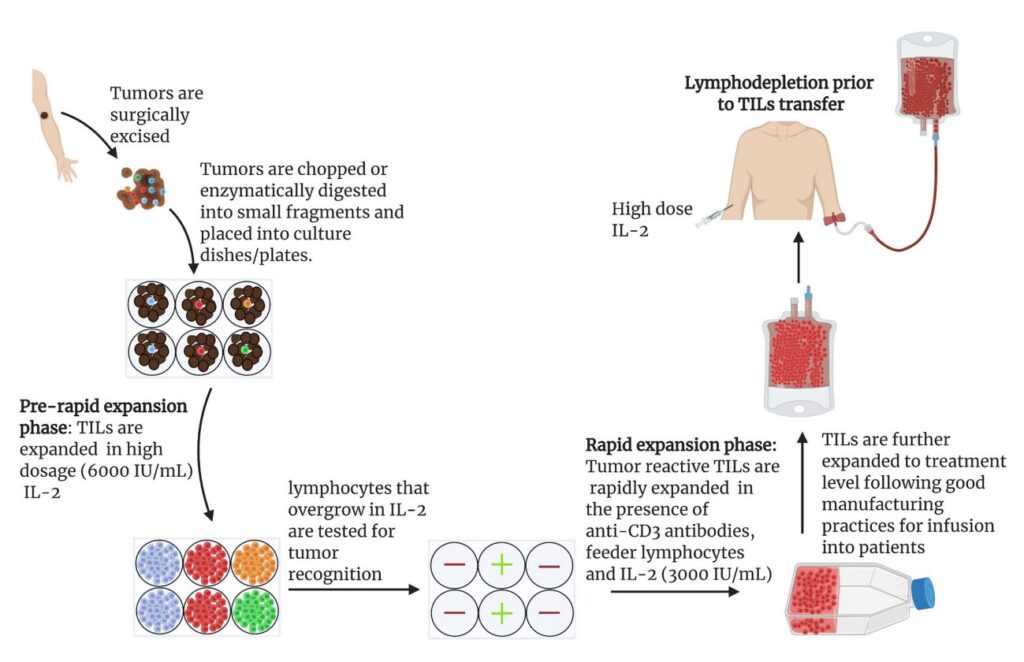
Difficultés liées à l'immunothérapie du cancer
Le traitement du cancer est entré dans une nouvelle phase avec l’immunothérapie, ce qui suscite l’optimisme de nombreuses personnes. Néanmoins, cette approche n’est pas exempte de complications. L’une des principales préoccupations est la capacité des cellules cancéreuses à développer une tolérance au fil du temps. En raison de leur forte production d’énergie par le processus de glycolyse, ces cellules nocives bloquent souvent des voies spécifiques importantes pour la gestion efficace des fonctions des lymphocytes T. Si ces lymphocytes T ne sont pas protégés, ils peuvent être détruits.
Si ces cellules T ne sont pas correctement maturées, elles ne parviennent pas à identifier et à neutraliser efficacement les cellules tumorales, ce qui les incite à s’appuyer sur la force acquise grâce aux anticorps thérapeutiques administrés précédemment.
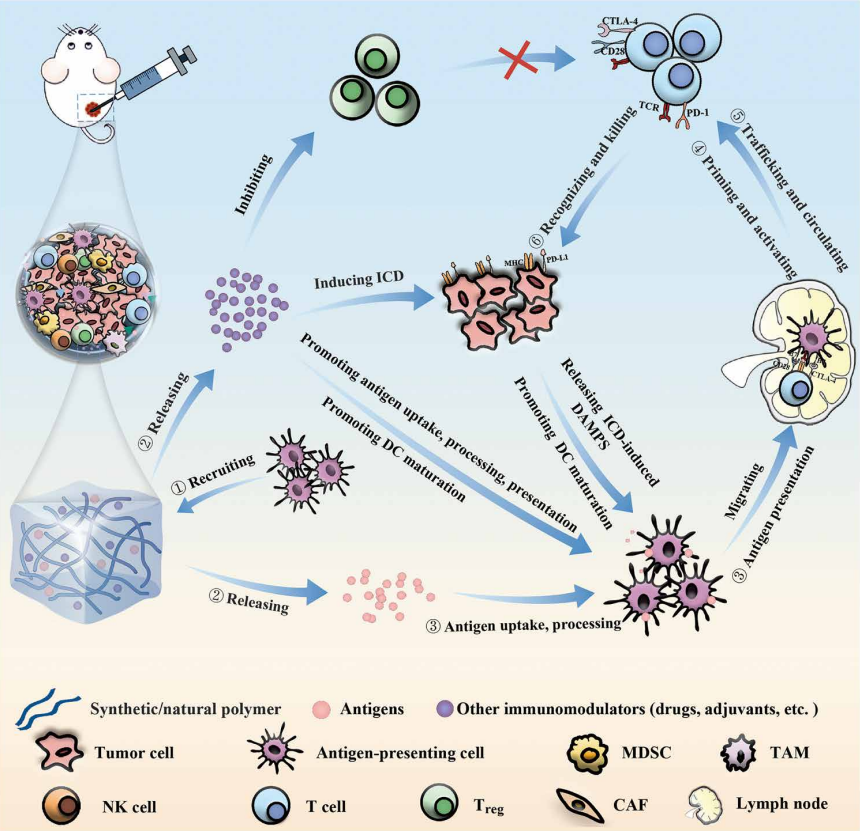
Faire face aux difficultés
En réponse à ces obstacles, il pourrait s’avérer avantageux d’orienter les efforts vers l’inhibition du système de production d’énergie des cellules tumorales après l’immunothérapie. En limitant leur alimentation en énergie, il est possible qu’elles soient incapables de bloquer les voies de signalisation qui dictent le développement et le contrôle des cellules T.Derniers résultats des études scientifiques : 2-désoxy-D-glucose (2DG)
Le traitement du cancer, en particulier du cancer du sein triple négatif (CSTN), connaît une évolution passionnante.
Les scientifiques ont découvert que la combinaison de l’immunothérapie avec un antimétabolite du glucose connu sous le nom de 2DG pourrait améliorer l’efficacité du traitement. Cette découverte est d’autant plus intéressante que les cellules du cancer du sein négatif présentent souvent des niveaux élevés d’une protéine appelée ligand 1 de la mort programmée (PD-L1).
En ce qui concerne le traitement du cancer du sein, seul un petit groupe de patients, environ 10 à 20 %, obtient des résultats positifs avec les thérapies qui ciblent PD-L1 ou PD-1, qui sont des acteurs clés de la réponse immunitaire de l’organisme.
Cette nouvelle approche, qui fait appel au 2DG, pourrait changer la donne pour de nombreux patients atteints de cancer du sein dont les réponses aux traitements sont actuellement limitées.
Voici un point essentiel : une forme particulière de PD-L1, connue sous le nom de PD-L1 glycosylé, est cruciale pour les interactions qui ont lieu dans le cadre PD-L1-PD-1. De plus, les cellules associées au cancer du sein ont tendance à présenter des niveaux plus élevés de PD-L1 glycosylé que les cellules non associées au cancer du sein.
La recherche a montré qu’il est possible de réduire la quantité de glycosylation sur PD-L1 en ayant un impact significatif sur la stabilité et la fonction de cette molécule pro-cancer qui inhibe le système immunitaire.
C’est là que le « désoxyglucose » entre en jeu. L’utilisation du désoxyglucose peut potentiellement perturber ce processus, conduisant à de nouvelles stratégies qui combinent différentes approches pour des résultats de traitement TNBC plus efficaces.
Techniques de traitement du cancer : Méthodes conventionnelles et progressives
La recherche de solutions efficaces contre le cancer fait appel à de nombreuses méthodes, allant des techniques conventionnelles aux techniques les plus avant-gardistes.
Les procédures de traitement établies telles que la chimiothérapie et la radiothérapie sont largement reconnues, tandis que de nouveaux éléments tels que le 2DG sont devenus progressivement attrayants en raison de leurs avantages potentiels dans le traitement du cancer, soit individuellement, soit en complément d’aides bien établies telles que le fenbendazole et le DCA, qui contribuent également de manière significative à la lutte contre la maladie.

Chimiothérapie
L’utilisation de la chimiothérapie reste un élément essentiel dans la lutte contre la maladie connue sous le nom de cancer. Elle est particulièrement efficace dans le cas de maladies telles que le cancer du sein, où elle est utilisée pour réduire la taille de la tumeur et faciliter l’ablation chirurgicale – une approche appelée chimiothérapie préopératoire ou PCT.
Cependant, même si elle permet de réduire les dimensions de la tumeur, on ne peut pas toujours compter uniquement sur cette méthode, car il existe de nombreux cas où les cellules malignes réapparaissent après le traitement.
Renforcer l'impact de la chimiothérapie grâce au 2DG
Des études indiquent que l’association de la chimiothérapie et du 2DG peut renforcer son efficacité. Fonctionnellement similaire au glucose, le 2DG est capable d’interférer avec les activités métaboliques des cellules cancéreuses, ce qui pourrait potentiellement accroître l’impact des traitements chimiothérapeutiques habituels.
La double utilisation symbolise le potentiel d’une réponse pathologique globale, ce qui implique des résultats de traitement plus forts et plus prolongés. De nombreux tests de laboratoire ainsi que des études sur les animaux ont été réalisés pour confirmer cette stratégie combinée.
Radiothérapie
Dans les cellules cancéreuses, la méthode autonome de régulation du métabolisme des sucres est la 2DG, mais elle est également associée à des formes de thérapie telles que la chimiothérapie et la radiothérapie.
En réalité, la radiothérapie joue un rôle crucial dans le traitement du cancer. Environ 60 % des personnes qui luttent contre cette maladie cruelle subiront ce type de traitement, seul ou en association avec d’autres traitements.
La radiothérapie, bien qu’elle soit un outil puissant dans la lutte contre le cancer, n’est pas sans poser de problèmes. Elle est efficace, sans aucun doute, mais elle peut avoir des effets secondaires indésirables au fil du temps. L’un des principaux problèmes est que les cellules cancéreuses peuvent développer une résistance aux radiations, et il existe également un risque d’endommager les cellules saines.
Pour résoudre ces problèmes, en particulier celui de la tolérance aux rayonnements, il est essentiel d’utiliser des inhibiteurs glycolytiques. Ces inhibiteurs agissent en coupant l’approvisionnement en énergie des cellules cancéreuses, les privant ainsi des nutriments dont elles ont besoin.
Il est donc plus difficile pour ces cellules cancéreuses de se réparer après avoir été touchées par des radiations, ce qui conduit à leur dégradation et à leur destruction. Cette approche constitue un pas en avant pour rendre la radiothérapie plus sûre et plus efficace pour les patients.
Amélioration de la radiothérapie par le 2-Deoxy-D-Glucose
Le 2DG joue le rôle d’inhibiteur glycolytique. Sa fonction consiste à se lier à la protéine transporteuse de glucose GLUT1 avant d’être phosphorylée par l’enzyme Hexokinase. Cependant, sa progression métabolique s’arrête là, garantissant que la voie glycolytique reste obstruée.
Ainsi, les cellules cancéreuses exposées à cet inhibiteur ne parviennent pas à produire de l’énergie en raison de l’interruption du processus normal de glycolyse du glucose. En outre, le 2DG stimule les fonctions des enzymes caspase 3 et PARP, ce qui entraîne l’apoptose des cellules malignes tout en laissant les cellules saines intactes.
Dans le traitement du cancer, une combinaison prometteuse se profile à l’horizon : le 2-désoxy-D-glucose (2DG) associé à la radiothérapie. Ce duo pourrait renforcer considérablement la puissance de la radiothérapie. Comment ?
Le 2DG agit comme un inhibiteur du glucose. Il interfère avec la capacité des cellules cancéreuses à se réparer après avoir été endommagées par les radiations, principalement parce que ces cellules sont privées de glucose et de nutriments essentiels.
Mais le 2DG ne se contente pas d’un seul rôle. Il remplit plusieurs fonctions. En plus d’être un perturbateur, il amplifie l’impact de la radiothérapie. Son action est liée à la modification de l’équilibre des processus d’oxydation-réduction au sein des cellules.
Il est important de noter que le stress oxydatif est considéré comme une voie clé par laquelle les rayonnements ionisants tuent les cellules cancéreuses. Cette nouvelle approche, qui utilise le 2DG en conjonction avec la radiothérapie, pourrait changer la donne dans le traitement efficace du cancer.
La diversité des cellules cancéreuses
Les cellules cancéreuses sont très diverses, ce que les scientifiques appellent l’hétérogénéité tumorale et que l’on retrouve dans presque tous les types de cancer. Cette diversité résulte souvent d’erreurs commises au cours du processus de réplication de l’ADN lorsque les cellules se divisent.
Voici ce qui se passe : Lorsque les cellules se divisent, s’il y a des erreurs dans la copie de leur ADN, de nouvelles cellules avec des mutations naissent. Au fil du temps, en particulier sous l’effet de certains facteurs environnementaux, ces cellules mutées peuvent évoluer et potentiellement conduire à un cancer. Il s’agit d’un processus lent, mais c’est ainsi que de nombreux cancers commencent leur parcours.
Différentes formes de disparité entre les cancers
La différenciation observée dans les cellules cancéreuses, appelée hétérogénéité tumorale, peut être divisée en deux catégories :
Hétérogénéité tumorale spatiale
Cela signifie que les cellules cancéreuses ne se répartissent pas uniformément dans le tissu affecté. Au contraire, elles ont tendance à se propager de manière désordonnée et imprévisible.
Fluctuations temporelles de la diversité tumorale
Au fil du temps, les tumeurs évoluent souvent vers différents sous-types. Ce processus est connu sous le nom d’hétérogénéité temporelle. Essentiellement, plus une tumeur se développe longtemps, plus elle peut devenir variée.
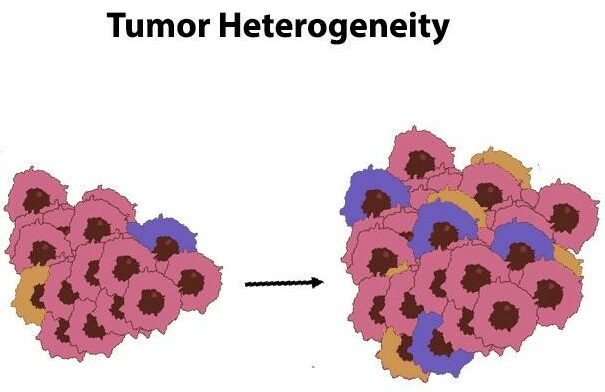
Les caractéristiques variables des cellules tumorales constituent des obstacles importants lorsqu’il s’agit de lutter efficacement contre le cancer. La diversité de ces cellules malignes entraîne souvent une résistance aux stratégies thérapeutiques actuelles.
Compte tenu de la complexité du comportement du cancer, il est urgent de mettre au point des traitements capables de cibler et de surmonter efficacement la résistance causée par la composition génétique variée des cellules cancéreuses.
Résultats des essais
Un large éventail d’études, y compris des tests en laboratoire, des études animales et des essais cliniques sur l’homme, ont permis d’étudier en profondeur les effets du 2-désoxy-D-glucose (2DG) sur les cellules. Ce qui ressort de ces recherches, c’est que le 2DG agit de manière complexe.
Il ne se contente pas d’arrêter le processus de glycolyse cellulaire, il favorise également l’apoptose, ou mort cellulaire programmée, sans nuire aux cellules saines. En outre, le 2DG a un impact sur le comportement des gènes dans les cellules.
Il perturbe les facteurs de transcription qui jouent un rôle clé dans l’activation des gènes essentiels à la réplication cellulaire. Cette découverte laisse entrevoir le potentiel du 2DG comme arme contre diverses caractéristiques des cellules cancéreuses.
Les cellules cancéreuses présentent diverses mutations génétiques qui jouent un rôle dans la progression de la maladie. Cependant, elles ont toutes un point commun : un taux de métabolisme du sucre plus élevé que celui des cellules normales.
C’est ce qui fait du 2DG un traitement potentiellement efficace pour une variété de cancers. Il agit en privant les cellules cancéreuses de sucre et d’oxygène, tout en affectant leur activité génétique. Cette approche peut ralentir la croissance des cellules et les orienter vers l’autodestruction, empêchant ainsi une croissance excessive.
Cure prospective pour le cancer du glioblastome
Le glioblastome est une forme particulièrement agressive de cancer du cerveau, connue pour sa forte résistance à la mort cellulaire et le succès limité des traitements actuels. Cette situation souligne le besoin urgent d’explorer de nouvelles options thérapeutiques.
Il n’y a pas si longtemps, le Dr Evangelos Michelakis, un scientifique médical dévoué, et son équipe se sont lancés dans plusieurs projets de recherche axés sur la thérapie du glioblastome multiforme (GBM). Ils ont réalisé que le traitement idéal devait être capable de traverser la barrière hémato-encéphalique et de cibler spécifiquement les cellules cancéreuses, sans endommager les tissus sains.
Leur choix, le dichloroacétate de sodium (DCA), présentait ces qualités et, surtout, ne présentait aucun signe de dommage pour le sang, le cœur, les reins ou le foie.
Cette découverte les a conduits à mener une étude historique sur de vrais patients, ouvrant la voie à d’autres découvertes révolutionnaires dans le traitement du GBM.
Impact du DCA sur la disparition des cellules cancéreuses et le développement des tumeurs
Il devient évident que le dichloroacétate (DCA) a un impact significatif sur la lutte contre le cancer, en particulier dans le cas du glioblastome, une forme mortelle de cancer du cerveau. Le DCA a la capacité d’induire la mort des cellules cancéreuses, de réduire les vaisseaux sanguins qui alimentent les tumeurs et de ralentir la croissance de ce cancer agressif.
Ce qui est particulièrement prometteur, c’est que le DCA pourrait être plus efficace lorsqu’il est utilisé en même temps que d’autres traitements, offrant ainsi une nouvelle lueur d’espoir dans la lutte contre cette maladie difficile.
Parallèlement à d'autres thérapies pour le glioblastome
Les scientifiques ont eu l’occasion de comparer les tissus cérébraux de patients avant et après le traitement au DCA. Ce qu’ils ont constaté est encourageant : une réduction des cellules cancéreuses dans le tissu cérébral après le traitement.
Ce résultat a été attribué à une augmentation de la destruction des cellules mortelles et à une diminution de la croissance des cellules malignes du glioblastome multiforme. La recherche a conclu que la combinaison du DCA avec d’autres traitements pourrait constituer une stratégie efficace contre le GBM.
L’équipe de recherche suggère d’utiliser le dichloroacétate, connu pour sa non-toxicité, avant ou après des procédures telles que la radiothérapie ou la chirurgie. Cette approche pourrait potentiellement renforcer les avantages des traitements standard du GBM.