Профессор нейрохирургии и онкологии Университета Джона Хопкинса доктор Грегори Риггинс и его исследовательская группа обычно практически не сталкиваются с трудностями при выращивании раковых опухолей у подопытных мышей, на которых проводятся исследования.
Однако в течение нескольких месяцев в 2009 году в одной группе мышей опухоль просто не развивалась. При дальнейшем изучении они обнаружили, что такой неожиданный результат был вызван тем, что этим грызунам вводили фенбендазол в качестве противопаразитарного средства.
«При изучении различных препаратов этой конкретной группы фенбендазол оказался наиболее эффективным. Это привлекло наше внимание». говорит исследователь.
По мере распространения информации о его способностях люди обнаружили, что фенбендазол можно применять самостоятельно или в сочетании с другими процедурами, чтобы вылечить или сдержать рост рака.
Риггинс и Галлиа вместе со своим исследовательским отрядом начали разработку схемы, которая должна была не только понять, как действует это лекарство, но и повысить его эффективность против клеток глиобластомы, а также наладить его производство для испытаний на пациентах. Согласно системе убеждений исследователей, фенбендазол помогает блокировать развитие опухоли, сдерживая образование тубулиновых нитей — белков, необходимых для размножения раковых клеток.
Это событие произошло более десяти лет назад. Сегодня, по прошествии значительного времени, мы накопили значительные знания об эффективном применении фенбена для повышения вероятности уничтожения рака.
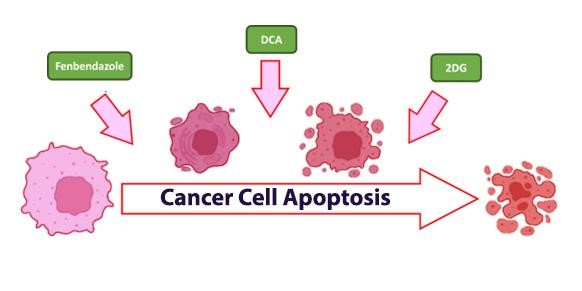
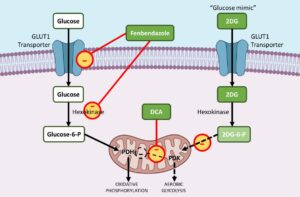
Модернизированные лекарственные препараты позволяют добиться значительных успехов в лечении рака. Благодаря пониманию того, как раковые клетки используют энергию, мы видим, как такие соединения, как фенбендазол, DCA (дихлорацетат натрия) и 2DG (2-дезокси-D-глюкоза), революционизируют стандартные методы лечения, такие как химиотерапия и радиация, давая новую надежду в лечении рака.
Энергетическая структура рака
В 1923 году Отто Генрих Варбург — крупнейший немецкий биохимик, практикующий врач и лауреат Нобелевской премии — сделал бесценное открытие, которое сыграло важную роль в понимании особенностей энергетического обмена раковых клеток. Именно это явление, наблюдаемое в настоящее время, признано ключевой характеристикой рака, получившей название «эффект Варбурга».
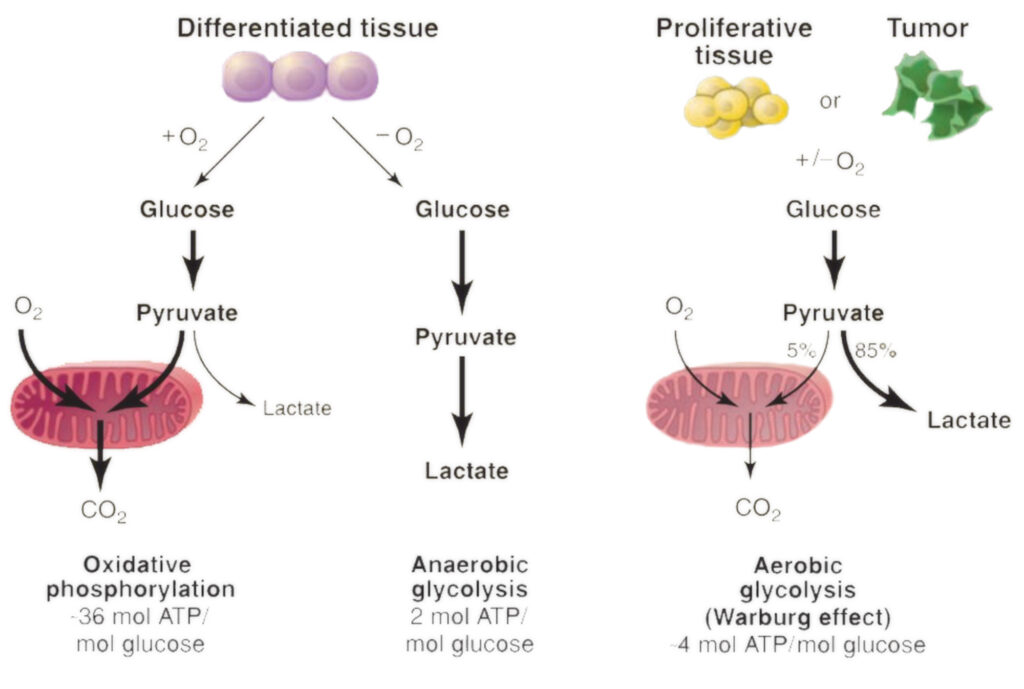
Примечательно наблюдение, сделанное Варбургом при изучении опухолевых клеток крыс: он отметил, что они процветали при исключительно высоком уровне глюкозы (сахара), вместо того чтобы усиленно использовать кислород для целей роста, что кажется нелогичным, поскольку извлечение энергии из питательных веществ с помощью более высокого уровня использования кислорода было бы в значительной степени эффективным процессом.
Подобные выводы, сделанные в те времена, около ста лет назад, вызвали значительное любопытство, которое привело к появлению вопросов, на которые не было ответов, а решения были доступны.
Огромная тяга к глюкозе и уменьшение потребления кислорода дают раковым клеткам определенный набор эволюционных преимуществ. Один из способов, которым влияние Варбурга помогает злокачественным клеткам, — это содействие быстрому накоплению биомассы. Усиленное поглощение глюкозы обеспечивает опухолевую ткань избыточными строительными блоками для создания нового генетического материала и белка, что приводит к ускорению пролиферации и разрастания рака.
Кроме того, ни для кого не секрет, что нормальные клетки млекопитающих нуждаются в постоянном притоке кислорода, иначе они быстро погибают. Однако их больные собратья ведут себя совершенно иначе — быстро растущие опухоли часто превышают доступный им запас кислорода, но в силу своей адаптивной природы не замедляются, а процветают в таких условиях, не задыхаясь.
Вскоре раковые клетки переводят свой метаболический процесс на кислородно-зависимый гликолиз. Они начинают вырабатывать и выбрасывать за пределы клеток большое количество молочной кислоты, что приводит к повышению кислотности в окружающей опухоль среде.
Повышенная кислотность такой раковой среды способствует дальнейшему проникновению и распространению опухоли, разрушая соединяющий клетки организма внеклеточный матрикс. Когда уровень кислотности повышается, это помогает злокачественным образованиям обойти механизм иммунитета — неотъемлемую защиту от подобных заболеваний. Несомненно, это одна из причин, по которой иммунотерапия часто теряет свою эффективность при работе с прогрессирующими стадиями рака.
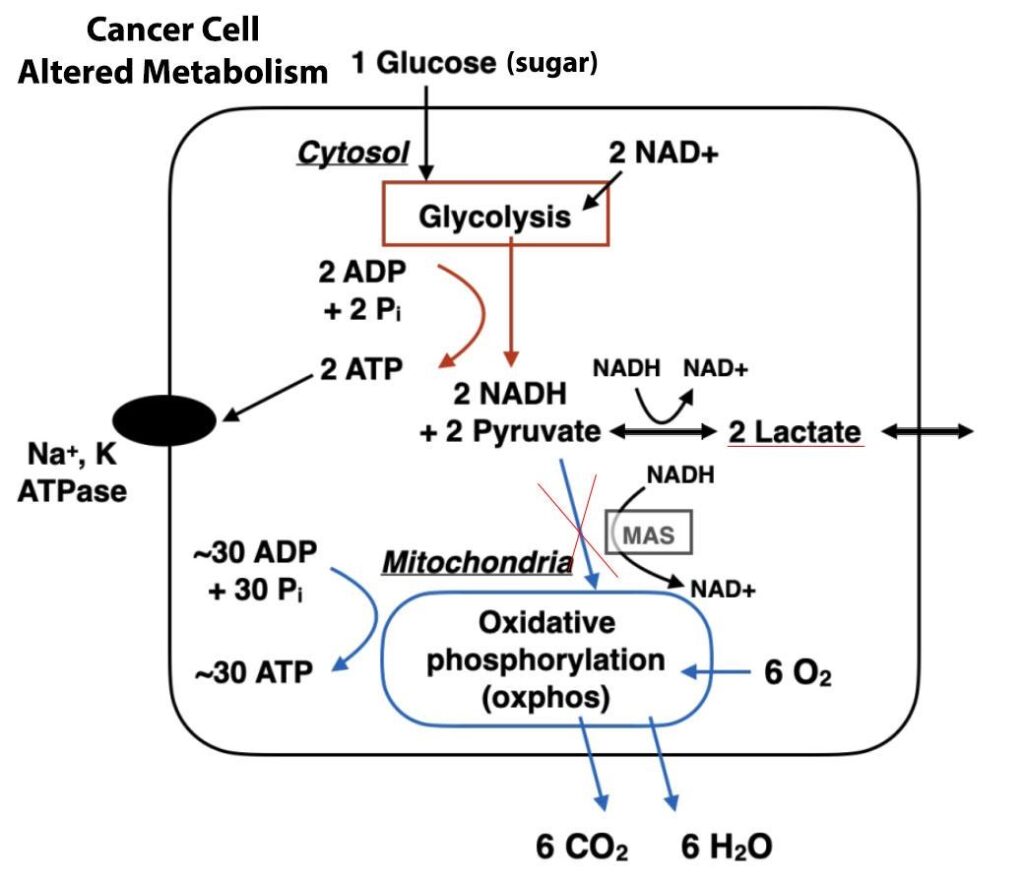
Одновременно раковые клетки потребляют меньше кислорода, в результате чего митохондрии внутри них вырабатывают меньше реактивных форм кислорода. Они играют важнейшую роль как в остановке, так и в уничтожении вредоносных раковых клеток. Болезнь начинает уклоняться от механизма, называемого апоптозом.
Апоптоз — это обычное явление, которое происходит в нашем организме; он удобно удаляет ненужные или лишние клетки, чтобы они не продолжали свое существование в анатомическом строении.
По сути, это естественная, заранее организованная клеточная смерть, останавливающая рост опухоли в самом начале, уничтожая саму себя, прежде всего для того, чтобы предотвратить потенциальное ненужное разрастание этих опухолей внутри нас, наносящих невосстановимый ущерб, и тем самым делая злокачественные клеточные тела неумирающими.
Это ключевые метаболические преимущества, позволяющие нерегулируемому жизненному циклу различных трансформаций развиваться бесконечно долго, оставаясь бессмертными благодаря сдерживанию запрограммированной своевременной гибели (апоптоза).
Отдельного упоминания заслуживает этот довольно запутанный процесс эволюции, которому подвергаются неопластические метаморфозы, что, как правило, бросает вызов врачам, делая такие недуги грозными противниками, требующими сложных протоколов лечения, но не стоит забывать и о другом аспекте — использовании эффекта Варбурга против канцерогенных веществ.
С точки зрения выявления заболеваний человечество использовало это явление ракового метаболизма в целях обнаружения. Тест, известный как позитронно-эмиссионная томография (ПЭТ), выявляет ткани и органы с необычной метаболической активностью.
Поскольку раковые клетки проявляют эффект Варбурга, они поглощают радиоактивную глюкозу со скоростью в сотни раз большей, чем окружающие их стандартные ткани. Таким образом, опухоли подсвечиваются на полученных изображениях, что позволяет легко отследить их по всему телу.
Что касается лечения, то признание того факта, что почти все предыдущие противораковые методы лечения были сосредоточены исключительно на генной терапии, может привести к тому, что смена парадигмы Варбурга может стать «ахиллесовой пятой» любого подхода к лечению рака на протяжении почти целого столетия. Альтернативное соединение — дихлорацетат натрия (ДХН) — действует уникальным образом, восстанавливая аномальные функции клеток, связанные с метаболизмом, и возвращая их в равновесие
Необходимость иммунотерапии
Раковые клетки разработали различные механизмы маскировки, которые делают их необнаружимыми для иммунной защиты организма. Они могут обладать генетическими мутациями или иметь особые поверхностные белки — оба фактора могут помешать иммунной системе распознать эти клетки и бороться с ними.
Именно в этом случае TILs играют важную роль. Если опухоль пациента не содержит этих TIL, это означает, что защитный иммунный ответ неэффективно борется со злокачественной опухолью, что требует иммунотерапевтического вмешательства.
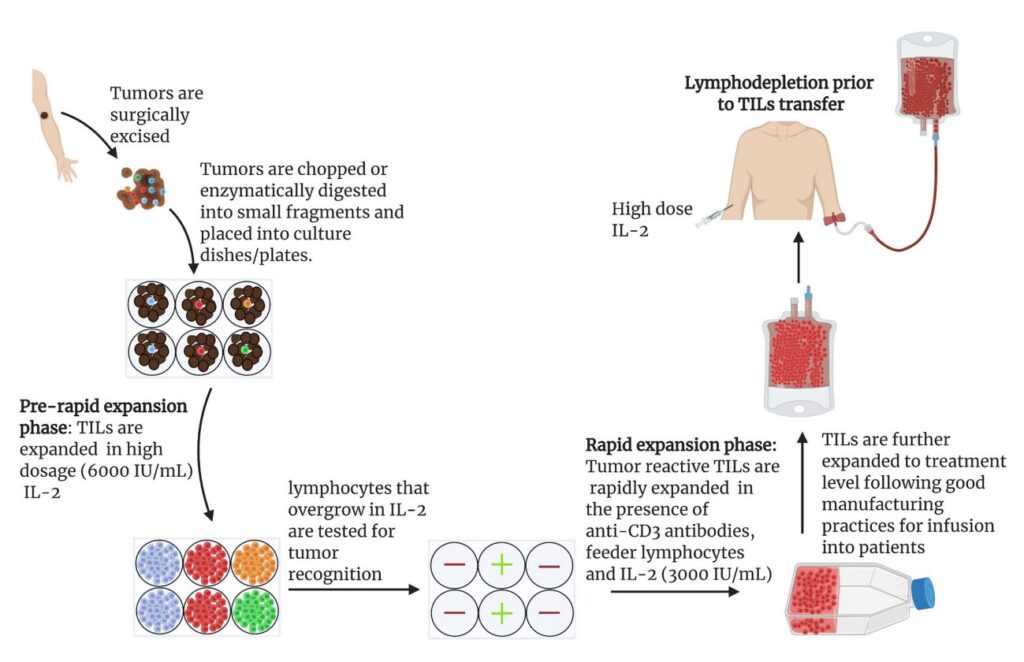
Трудности иммунотерапии рака
Лечение рака вступило в новую фазу с появлением иммунотерапии, что вселяет оптимизм в сердца многих людей. Тем не менее, этот подход не лишен сложностей. Основное беспокойство вызывает способность раковых клеток со временем вырабатывать толерантность. Благодаря высокой выработке энергии в процессе гликолиза, эти вредоносные клетки часто блокируют определенные пути, важные для эффективного управления функциями Т-клеток.
Если эти Т-клетки не созрели, они не могут успешно идентифицировать и эффективно нейтрализовать опухолевые клетки, и вместо этого они продвигаются за счет предыдущей силы, полученной от терапевтических антител, введенных ранее.
Преодоление трудностей
.
В ответ на эти препятствия можно направить усилия на подавление системы производства энергии опухолевыми клетками после иммунотерапии. Ограничив их энергоснабжение, можно добиться того, что они будут неспособны блокировать сигнальные пути, определяющие развитие и контроль Т-клеток.
Результаты последних научных исследований: 2-дезокси-D-глюкоза (2DG)
В области лечения рака, особенно тройного негативного рака молочной железы (TNBC), появилась интересная разработка.
Ученые обнаружили, что сочетание иммунотерапии с антиметаболитом глюкозы, известным как 2DG, может повысить эффективность лечения. Это особенно примечательно, поскольку в клетках TNBC часто обнаруживается высокий уровень белка, называемого лигандом программируемой смерти 1 (PD-L1).
Что касается лечения TNBC, то лишь небольшая группа пациентов, примерно 10-20 %, получает положительные результаты от терапии, направленной на PD-L1 или PD-1, которые являются ключевыми игроками в иммунном ответе организма.
Новый подход с использованием 2DG потенциально может изменить ситуацию для многих пациентов с TNBC, которые в настоящее время имеют ограниченные результаты лечения.
Ключевой момент: особая форма PD-L1, известная как гликозилированный PD-L1, имеет решающее значение для взаимодействий, которые происходят в рамках PD-L1-PD-1. Более того, клетки, ассоциированные с TNBC, имеют более высокий уровень этого гликозилированного PD-L1 по сравнению с клетками, не относящимися к TNBC.
Исследования показали, что, существенно влияя на стабильность и функционирование этой прораковой молекулы, ингибирующей иммунитет, можно уменьшить количество гликозилирования на PD-L1.
Именно здесь в игру вступает «дезоксиглюкоза». Использование дезоксиглюкозы может потенциально нарушить этот процесс, что приведет к появлению новых стратегий, сочетающих различные подходы для более эффективного лечения TNBC.
Методы лечения рака: Традиционные и прогрессивные методы
Путь к эффективным решениям проблемы рака включает в себя множество методов, от традиционных до более авангардных.
Широкое признание получили такие традиционные методы лечения, как химиотерапия и радиотерапия, в то время как новые элементы, такие как 2DG, становятся все более привлекательными благодаря их перспективным преимуществам в лечении рака как по отдельности, так и в сочетании с хорошо зарекомендовавшими себя средствами, такими как фенбендазол и DCA, которые также вносят значительный вклад в борьбу с заболеванием.

Химиотерапия
Применение химиотерапии по-прежнему является ключевым элементом в борьбе с заболеванием, известным как рак. Она особенно эффективна при таких заболеваниях, как рак молочной железы, когда ее используют для уменьшения размеров опухоли и облегчения ее хирургического удаления — такой подход называется предоперационной химиотерапией или ПХТ.
Однако, несмотря на уменьшение размеров опухоли, мы не всегда можем полагаться только на этот метод, поскольку существует множество случаев, когда злокачественные клетки вновь появляются после лечения.
Усиление эффекта от химиотерапии с помощью 2DG
Исследования показывают, что сочетание химиотерапии с 2DG может усилить ее эффективность. Функционально напоминающий глюкозу, 2DG способен вмешиваться в метаболическую деятельность внутри раковых клеток, что потенциально может усилить эффект от обычного химиотерапевтического лечения.
Двойное использование символизирует потенциал для комплексного патологического ответа, что подразумевает достижение более сильных и длительных результатов лечения. Для подтверждения этой комбинированной стратегии были проведены многочисленные лабораторные тесты, а также исследования на животных.
Лучевая терапия
В раковых клетках самостоятельным методом регуляции сахарного обмена является 2DG, но он также сочетается с такими видами терапии, как химиотерапия и радиотерапия.
В реальности радиотерапия играет важнейшую роль в лечении рака. Примерно 60 % людей, борющихся с этим жестоким заболеванием, проходят этот вид лечения либо отдельно, либо в сочетании с другими методами.
Радиотерапия, хотя и является мощным инструментом в борьбе с раком, не лишена своих проблем. Она, несомненно, эффективна, но со временем может вызвать ряд нежелательных побочных эффектов. Одна из главных проблем заключается в том, что раковые клетки могут выработать устойчивость к облучению, а также существует риск повреждения здоровых клеток.
Чтобы решить эти проблемы, особенно проблему устойчивости к облучению, крайне важно использовать ингибиторы гликолиза. Эти ингибиторы работают за счет прекращения подачи энергии к раковым клеткам, по сути, лишая их необходимых питательных веществ.
Таким образом, раковым клеткам становится сложнее восстанавливаться после воздействия радиации, что в конечном итоге приводит к их разрушению и гибели. Такой подход — это шаг вперед в деле повышения безопасности и эффективности лучевой терапии для пациентов.
Усиление радиотерапии с помощью 2-дезокси-D-глюкозы
2DG действует как гликолитический ингибитор. Его функция заключается в связывании с белком-транспортером глюкозы GLUT1 до его фосфорилирования ферментом гексокиназой. Однако на этом его метаболическое действие заканчивается, и гликолитический путь остается заблокированным.
Таким образом, раковые клетки, подвергшиеся воздействию этого ингибитора, не могут производить энергию из-за прерывания нормального процесса гликолиза глюкозы. Кроме того, 2DG запускает функции ферментов каспазы 3 и PARP, что приводит к апоптозу злокачественных клеток, а здоровые клетки остаются незатронутыми.
В лечении рака на горизонте появилась многообещающая комбинация: 2-дезокси-D-глюкоза (2DG) в паре с радиотерапией. Этот дуэт может значительно усилить мощь лучевой терапии. Каким образом?
2DG действует как ингибитор глюкозы. Он препятствует способности раковых клеток восстанавливаться после облучения, главным образом потому, что эти клетки испытывают недостаток глюкозы и необходимых питательных веществ.
Но 2DG — это не просто «пони с одним фокусом». Он выполняет множество функций. Помимо того, что он является разрушителем, он также усиливает воздействие лучевой терапии. Его действие связано с изменением баланса окислительно-восстановительных процессов в клетках.
Важно отметить, что окислительный стресс считается ключевым путем, через который ионизирующее излучение убивает раковые клетки. Этот новый подход, использующий 2DG в сочетании с радиотерапией, может стать переломным моментом в эффективном лечении рака.
Разнообразие раковых клеток
Раковые клетки отличаются разнообразием, которое ученые называют опухолевой гетерогенностью, и его можно встретить практически в каждом виде рака. Такое разнообразие часто возникает из-за ошибок, допущенных в процессе репликации ДНК при делении клеток.
Вот что происходит: При делении клеток, если в процессе копирования их ДНК происходят ошибки, рождаются новые клетки с мутациями. Со временем, особенно при воздействии определенных факторов окружающей среды, эти мутировавшие клетки могут эволюционировать и потенциально привести к раку. Это медленный процесс, но именно так начинается путь многих видов рака.
Различные формы ракового неравенства
Дифференциацию, наблюдаемую в раковых клетках и называемую гетерогенностью опухоли, можно условно разделить на два вида:
Пространственная гетерогенность опухоли.
Это означает, что раковые клетки не распределяются равномерно по пораженной ткани. Вместо этого они распространяются бессистемно и непредсказуемо.
Временные колебания диверсификации опухоли.
По мере развития опухоли со временем часто превращаются в различные подтипы. Этот процесс известен как временная гетерогенность. По сути, чем дольше растет опухоль, тем более разнообразной она может стать.
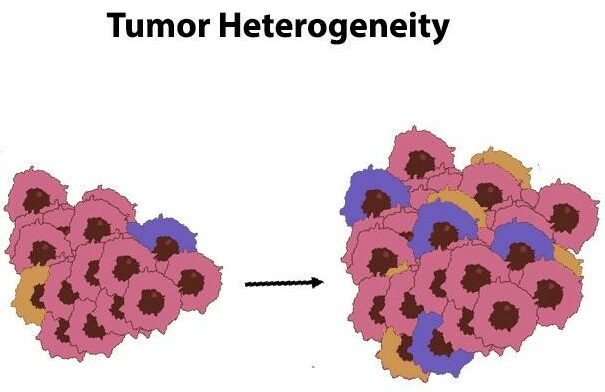
Различные характеристики опухолевых клеток создают значительные препятствия для эффективной борьбы с раком. Разнообразная природа этих злокачественных клеток часто приводит к устойчивости к существующим терапевтическим стратегиям.
Учитывая такую сложность поведения раковых клеток, возникает острая необходимость в разработке методов лечения, которые могли бы эффективно воздействовать и преодолевать сопротивление, вызванное разнообразным генетическим составом отдельных раковых клеток.
Результаты испытаний
Широкий спектр исследований, включая лабораторные тесты, исследования на животных и клинические испытания на людях, позволил глубоко изучить влияние 2-дезокси-D-глюкозы (2DG) на клетки. В результате этих исследований выяснилось, что 2DG действует комплексно.
Он не просто останавливает процесс клеточного гликолиза, но и способствует апоптозу, или запрограммированной гибели клеток, не причиняя вреда здоровым клеткам. Кроме того, 2DG влияет на поведение генов в клетках.
Он нарушает работу факторов транскрипции, которые являются ключевыми для активации генов, необходимых для репликации клеток. Этот факт указывает на потенциал 2DG как оружия против различных характеристик раковых клеток.
Следует отметить, что раковые клетки отличаются разнообразием генетических мутаций, которые играют определенную роль в прогрессировании заболевания. Однако все они имеют одну общую черту: более высокую скорость метаболизма сахара по сравнению с нормальными клетками.
Это делает 2DG потенциально эффективным средством лечения различных видов рака. Он действует, лишая раковые клетки сахара и кислорода и одновременно влияя на активность их генов. Такой подход позволяет замедлить рост клеток и направить их на самоуничтожение, предотвращая чрезмерное разрастание.
Перспективное лекарство от рака глиобластомы
Глиобластома — особенно агрессивная форма рака мозга, известная своей устойчивостью к гибели клеток и ограниченным успехом существующих методов лечения. Такая ситуация подчеркивает острую необходимость поиска новых вариантов лечения.
Не так давно доктор Эвангелос Микелакис, ученый-медик, и его команда начали несколько исследовательских проектов, посвященных терапии глиобластомы (GBM). Они поняли, что идеальное лечение должно быть способно преодолевать гематоэнцефалический барьер и целенаправленно воздействовать на раковые клетки, не нанося вреда здоровым тканям.
Выбранный ими дихлорацетат натрия (ДХА) обладал этими качествами и, что важно, не вызывал никаких признаков повреждения крови, сердца, почек или печени.
Это открытие побудило их провести эпохальное исследование с участием реальных пациентов, проложив путь к дальнейшим революционным открытиям в области лечения ГБМ.
Влияние DCA на гибель раковых клеток и развитие опухоли
Становится ясно, что дихлорацетат (DCA) оказывает значительное влияние на борьбу с раком, особенно в случае с глиобластомой, смертельно опасной формой рака мозга. DCA способен вызывать гибель раковых клеток, уменьшать количество кровеносных сосудов, питающих опухоль, и замедлять рост этого агрессивного рака.
Особенно многообещающим является то, что DCA может быть наиболее эффективным при использовании в сочетании с другими методами лечения, что дает новый луч надежды в борьбе с этим сложным заболеванием.
Наряду с другими методами лечения глиобластомы
В редких случаях ученые получили возможность сравнить ткани мозга пациентов до и после лечения DCA. То, что они увидели, обнадеживает: после лечения в тканях мозга уменьшилось количество раковых клеток.
Это объяснялось увеличением разрушения смертоносных клеток и снижением роста злокачественных клеток глиобластомы. Авторы исследования пришли к выводу, что сочетание DCA с другими методами лечения может стать эффективной стратегией борьбы с GBM.
Исследовательская группа предлагает использовать дихлорацетат, который известен своей нетоксичностью, до или после таких процедур, как радиотерапия или хирургическое вмешательство. Такой подход может потенциально усилить преимущества стандартных методов лечения ГБМ.