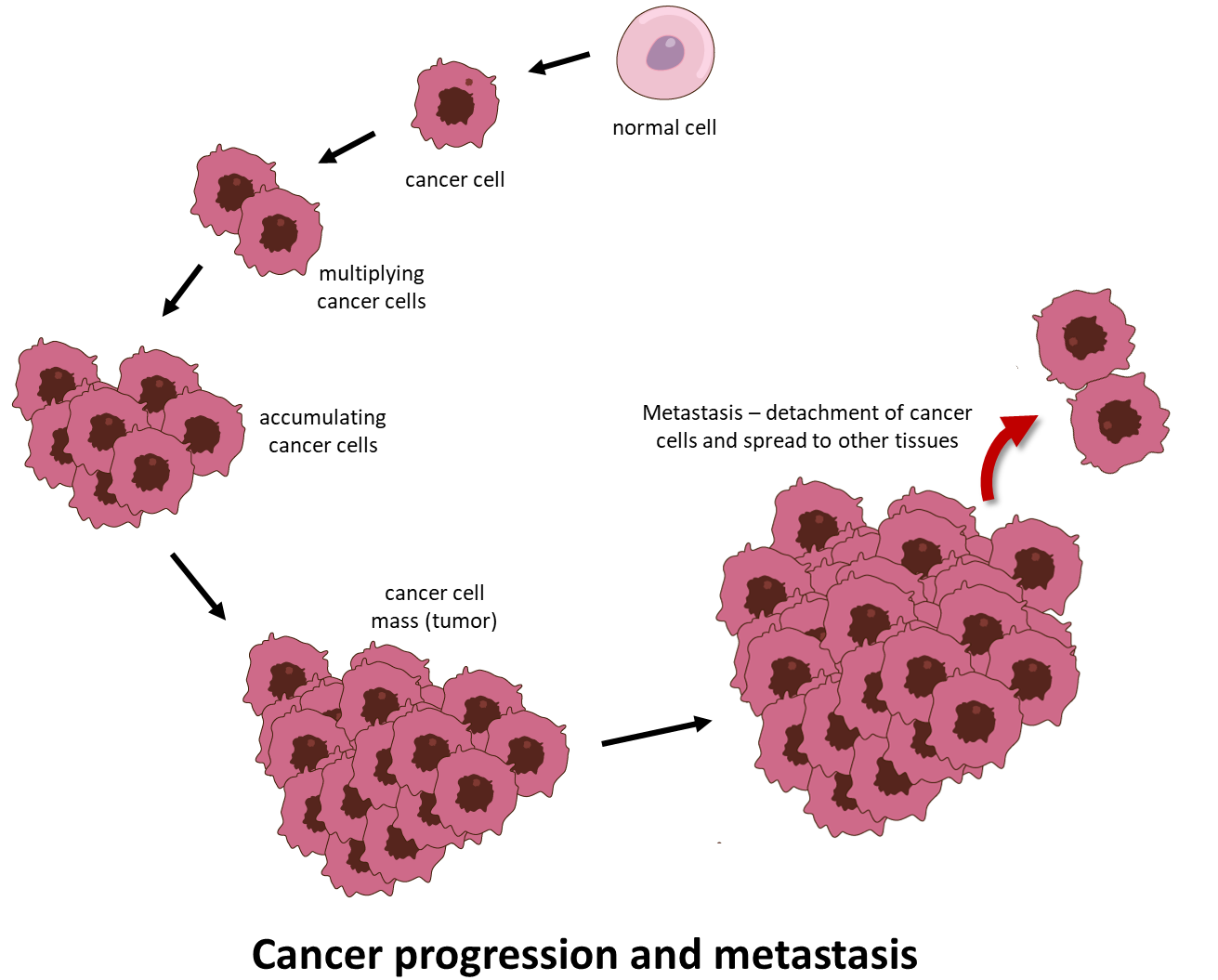
Рак — это страшное заболевание, при котором аномальные клетки неконтролируемо делятся и приобретают способность распространяться за пределы места своего возникновения, проникая в отдаленные ткани и органы и разрушая их. Этот последний процесс называется метастазированием и является самой распространенной причиной смерти от рака (рис. 1).
В 2020 году в мире было зарегистрировано 19,3 миллиона новых случаев заболевания раком; из них 10,0 миллионов умерли.1 Заболеваемость раком продолжает расти, как и количество смертей от него. Быстрый прогресс в исследованиях рака за последние пять десятилетий выявил тот факт, что в процессе опухолеобразования раковые клетки приобретают изменения в клеточной физиологии, которые отличают их от нормальных клеток. Эти приобретенные способности, также известные как отличительные признаки рака (рис. 2), являются общими для всех типов рака.2 К этим общим признакам относятся:
- Самодостаточность в сигналах роста. В отличие от нормальных клеток, раковые клетки не зависят от экзогенных факторов роста для активной пролиферации. Вместо этого они приобретают способность синтезировать факторы роста, на которые они реагируют, создавая сигнальную петлю с положительной обратной связью.
- Уклонение от супрессоров роста. В отличие от нормальных клеток, в которых многочисленные антипролиферативные растворимые ингибиторы роста действуют для поддержания клеточного покоя и тканевого гомеостаза, раковые клетки каким-то образом учатся уклоняться от антипролиферативных сигналов, замедляющих рост клеток. Поэтому раковые клетки продолжают пролиферировать даже в присутствии супрессоров роста.
- Сопротивление клеточной смерти. Раковые клетки противостоят естественным путям клеточной смерти, которые уничтожают ненужные или потенциально опасные клетки.
- Ангиогенез. Раковые клетки быстро наращивают кровеносные сосуды посредством ангиогенеза, чтобы соединиться с кровеносной системой и получить доступ к кислороду и питательным веществам для выживания и размножения.
- Инвазия и метастазирование. Раковые клетки перемещаются из первичного очага в отдаленные места: а) чтобы избежать иммунного надзора; б) чтобы преодолеть недостаток кислорода и необходимых питательных веществ из-за большого размера опухоли; в) чтобы избежать гибели клеток, вызванной накоплением избытка молочной кислоты.
- Уклонение от иммунитета. Опухоли могут уклоняться от атак иммунной системы с помощью различных механизмов, таких как ограничение распознавания антигенов, то есть они обманывают иммунную систему, не позволяя ей распознавать раковые клетки, а также вызывают истощение Т-клеток, солдат иммунной системы, которые распознают раковые клетки-изгои.
- Воспаление, способствующее развитию опухоли. При нормальной воспалительной реакции иммунная клетка вырабатывает химические вещества, которые убивают патоген. Эти химические вещества, известные как реактивные виды кислорода, могут также повреждать ДНК нормальных клеток, что, в свою очередь, повышает риск мутаций и впоследствии приводит к развитию рака из-за хронического воспаления.
- Мутация (мутации) и нестабильность генома. Это происходит из-за повышенной склонности к изменению генома во время деления клетки. Аберрантная репликация ДНК способствует приобретению мутаций и нестабильного генома, что, в свою очередь, приводит к развитию злокачественной опухоли.
- Эпигенетическое перепрограммирование. Это изменения в структуре хроматина, лежащего в основе гена. Такие изменения могут включать онкоген, вызывающий рак, или выключать ген-супрессор опухоли и способствовать процессу опухолеобразования.
- Полиморфные геномы. Или генетические вариации в генах, регулирующих репарацию несоответствий ДНК, регуляцию клеточного цикла, метаболизм и иммунитет, повышают предрасположенность к раку.
- Фенотипическая пластичность. Способность раковых клеток к динамическим изменениям формы, размера, морфологии и т. д. способствует уклонению от иммунитета и лекарственной устойчивости, а также способствует инвазии и миграции раковых клеток на большие расстояния.
- Метаболическое перепрограммирование. Способность раковых клеток изменять свой метаболизм, чтобы удовлетворить повышенную потребность в энергии быстро пролиферирующих раковых клеток, и при этом стать «бессмертными».
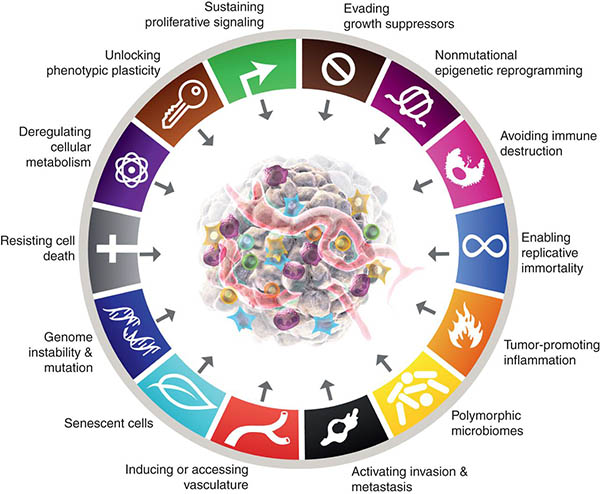
(Любезно предоставлено журналом Cancer Discovery Journal https://www.aacr.org/blog/2022/01/21/new-dimensions-in-cancer-biology-updated-hallmarks-of-cancer-published/)
Современные Проблемы Поиска Правильного Лечения Рака
Поскольку существует множество факторов, способствующих трансформации нормальных клеток в злокачественные раковые, профилактика остается очень сложной, а ликвидация рака после его появления по-прежнему представляет собой огромную проблему. Традиционная терапия рака, включая химиотерапию и лучевую терапию, направлена в первую очередь на активно пролиферирующие клетки.
Химиотерапевтические препараты не различают активно делящиеся нормальные и раковые клетки. Поэтому у пациентов наблюдаются тяжелые токсические эффекты, связанные с непреднамеренной, но неизбежной гибелью нормальных клеток. Это приводит к нейротоксичности, кардиотоксичности, токсичности желудочно-кишечного тракта и подавлению иммунитета. Кроме того, к химиотерапевтическим препаратам часто возникает резистентность.3,4
Поэтому многие онкологические пациенты, у которых болезнь рецидивирует после короткой ремиссии, остро нуждаются в альтернативных препаратах, которые также направлены на борьбу с другими признаками рака и вызывают меньшую токсичность.
Метаболическое Перепрограммирование: Ключевая Причина Неудач Существующих Методов Лечения Рака
Глюкоза — основной источник энергии для нормальных эукариотических клеток, не являющихся раковыми. В процессе метаболизма глюкозы нормальные клетки производят CO2 посредством окислительного фосфорилирования в аэробных условиях или лактат посредством гликолиза в анаэробных условиях. В раковых клетках ключевую роль играет метаболический сдвиг в сторону чрезмерного потребления глюкозы — более чем в 200 раз выше нормальной скорости, известный как аэробный гликолиз или эффект Варбурга.5,6
В отличие от нормальных тканей, где гликолиз в клетках происходит только в условиях недостатка кислорода или в аэробных условиях, раковые клетки перепрограммируют метаболический путь на гликолиз даже в аэробных условиях, чтобы удовлетворить высокую потребность в энергии при неконтролируемом делении клеток; это называется эффектом Варбурга или аэробным гликолизом и является критической чертой, которая отличает раковые клетки от нормальных клеток.
Это метаболическое изменение приводит к перепроизводству лактата, который затем выводится из клеток. Это изгнание приводит к накоплению молочной кислоты, что способствует закислению микроокружения опухоли, а это состояние может подавлять иммунную систему и потенциально снижать эффективность некоторых методов иммунотерапии.
Почему Низкосахарные/Кетогенные Диеты Неэффективны?
Кроме того, такие стратегии, как кетогенная диета или отказ от сахара, как правило, неэффективны в этом контексте. Такие подходы часто ускоряют кахексию — тяжелую форму потери мышечной массы и веса, что ускоряет прогрессирование смертности.7
Эта неэффективность объясняется прежде всего тем, что раковые клетки умеют извлекать необходимые питательные вещества из мышц (в частности, глютамин) и других тканей для своего пропитания, тем самым сводя на нет предполагаемое воздействие диетических ограничений.
Использование Нераковых Лекарств Для Борьбы С Раком
Разработка новых противораковых препаратов становится все более сложной и дорогостоящей. Чтобы найти эффективное терапевтическое средство от рака, очень полезными оказываются препараты, которые уже клинически одобрены или экспериментально проверены для лечения других заболеваний, кроме рака, но при этом обладают ранее не признанной цитотоксичностью по отношению к злокачественным клеткам.
Исследователи рака выявили некоторые лекарственные молекулы, которые могут стать подходящими противораковыми кандидатами наряду с традиционными методами лечения. Таким образом, повторное использование лекарств с противораковой эффективностью можно считать важной стратегией лечения рака на сегодняшний день.8
Поскольку описанный выше механизм метаболического перепрограммирования, с помощью которого стандартные методы лечения рака обычно терпят неудачу, было бы наиболее разумно сосредоточиться на перепрограммированных лекарственных кандидатах, которые борются именно с этим механизмом. Таким образом, несмотря на то, что существует множество перспективных лекарственных кандидатов, способных дополнить существующие противораковые терапии, есть все основания сосредоточиться на тех препаратах, которые преодолевают одну специфическую отличительную черту рака: метаболическое перепрограммирование.
Препараты, помогающие преодолеть метаболическое перепрограммирование при раке: Фенбендазол, дихлорацетат натрия (DCA) и 2-дезокси-D-глюкоза (2-DG)
a) Как три препарата обладают уникальными, независимыми и синергетическими механизмами борьбы с избыточным потреблением глюкозы в раковых клетках:
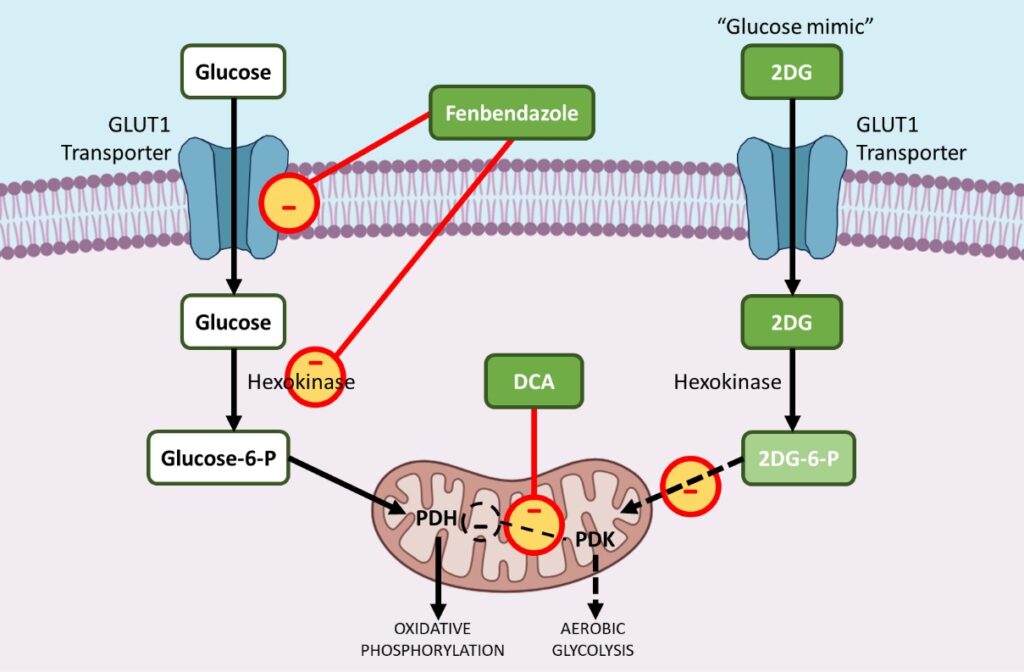
i. Фенбендазол — снижает уровень транспортеров GLUT и влияет на гексокиназу 2
Фенбендазол (FBZ) (метил N-(6-фенилсульфанил-1H-бензимидазол-2-ил) карбамат) относится к классу бензимидазольных препаратов, который находит применение в качестве противоракового средства. FBZ обладает доказанным противораковым эффектом, поскольку он останавливает пролиферацию клеток, снижает поглощение глюкозы и вызывает апоптотическую гибель клеток.9 ,10,11
Таким образом, повторное использование фенбендазола является важным вариантом терапии рака, позволяющим сократить время и затраты на разработку новых препаратов.
Рак связан с нарушением обмена веществ, при котором раковые клетки избирательно предпочитают неэффективный аэробный гликолиз (при котором вырабатывается всего 2 молекулы АТФ) митохондриальному окислительному фосфорилированию (при котором вырабатывается 38 молекул АТФ) для удовлетворения своих энергетических потребностей. Аэробный гликолиз — неэффективный энергетический процесс, поэтому раковым клеткам необходимо увеличить потребление глюкозы в несколько раз.
Раковые клетки увеличивают поглощение глюкозы за счет повышения уровня GLUT1, мембранного белка, который облегчает базальное поглощение глюкозы. Лечение ФБЗ приводит к снижению поглощения глюкозы раковыми клетками за счет снижения регуляции транспортеров GLUT и других ключевых гликолитических ферментов, таких как гексокиназа II (HKII).
Чтобы стимулировать аэробный гликолиз, многие гликолитические ферменты повышаются в процессе опухолеобразования. Гексокиназа II (HKII), ключевой гликолитический фермент, играет важнейшую роль в удержании глюкозы и метаболизме, фосфорилируя глюкозу до глюкозо-6-фосфата, который затем может вступить в гликолиз.
Таким образом, HKII является очень полезным ферментом для выживания и пролиферации раковых клеток. ФБЗ нарушает ферментативную функцию HKII в раковых клетках, что приводит к снижению удержания глюкозы в клетках, обработанных ФБЗ, и в конечном итоге раковые клетки погибают, поскольку не могут использовать глюкозу в качестве источника энергии через аэробный гликолиз.11
Преодоление Метаболического Программирования В Раке С Помощью Фенбендазола, DCA И 2-DG
ii. DCA — ингибирует киназу пируватдегидрогеназы (PDK)
Дихлорацетат натрия (ДХА), небольшая молекула, уже использовавшаяся для лечения острого и хронического молочнокислого ацидоза, была в значительной степени перепрофилирована в противораковый препарат.12,13
Раковые клетки получают энергию за счет избыточного гликолиза вместо митохондриального окислительного фосфорилирования. Усиливая аэробный гликолиз и повышая кислотность микроокружения опухоли, раковые клетки получают явное преимущество. Метаболический ацидоз в микроокружении опухоли подавляет апоптоз или естественные механизмы клеточной смерти и способствует формированию устойчивости к лекарствам.
В процессе канцерогенеза большинство гликолитических ферментов повышается, в то время как ферменты, способствующие окислительному фосфорилированию в митохондриях, преимущественно снижаются. Киназа пируватдегидрогеназы (PDK) — это фермент, регулирующий поступление глюкозы в митохондрии, где происходит окислительное фосфорилирование. В присутствии активированной PDK пируватдегидрогеназа (PDH), фермент про-окислительного фосфорилирования, ингибируется, ограничивая поступление пирувата в митохондрии, где может происходить окисление глюкозы.
Это смещает метаболизм в сторону гликолиза. DCA избирательно воздействует на раковые клетки, переводя их метаболизм с гликолиза на окислительное фосфорилирование путем ингибирования киназы пируватдегидрогеназы (PDK), ингибитора пируватдегидрогеназы (PDH).
Активация ферментов PDH способствует окислительному фосфорилированию вместо аэробного гликолиза — предпочтительного пути, с помощью которого раковые клетки удовлетворяют высокую потребность в энергии, что нарушает метаболические преимущества раковых клеток и делает их более чувствительными к химиотерапевтическим препаратам.
iii. 2-DG — аналог глюкозы или «имитатор», который блокирует ключевые ферменты, такие как гексокиназа и глюкозо-6-фосфат-изомераза
2-дезокси-D-глюкоза (2-DG) — это природный, не метаболизируемый аналог глюкозы, в котором 2-гидроксильная группа заменена на водород. 2DG конкурентно ингибирует поглощение глюкозы, поскольку и глюкоза, и 2-DG транспортируются внутрь клетки ферментом, переносящим глюкозу (GLUT1). 14,15,16
Когда внутри раковой клетки транспортируется меньше глюкозы, снижается аэробный гликолиз. Снижение гликолиза в конечном итоге останавливает активную клеточную пролиферацию раковых клеток.
Во-вторых, после попадания в клетку гексокиназа фосфорилирует глюкозу и 2DG с образованием глюкозо-6-фосфата и 2-дезокси-D-глюкозо-6-фосфата (2DG-6-P) соответственно.
2DG-6-P не может быть подвергнут дальнейшему метаболизму через гликолиз. Таким образом, он конкурентно ингибирует производство глюкозо-6-фосфата из глюкозы в процессе гликолиза и тем самым подавляет метаболизм глюкозы в раковых клетках.
2DG-6-P не может быть подвергнут дальнейшему метаболизму через гликолиз. Таким образом, он конкурентно ингибирует производство глюкозо-6-фосфата из глюкозы в процессе гликолиза и тем самым подавляет метаболизм глюкозы в раковых клетках..
b) Каким образом три препарата обладают уникальными, независимыми и синергетическими механизмами, вызывающими селективный апоптоз в раковых клетках, но не в нормальных клетках
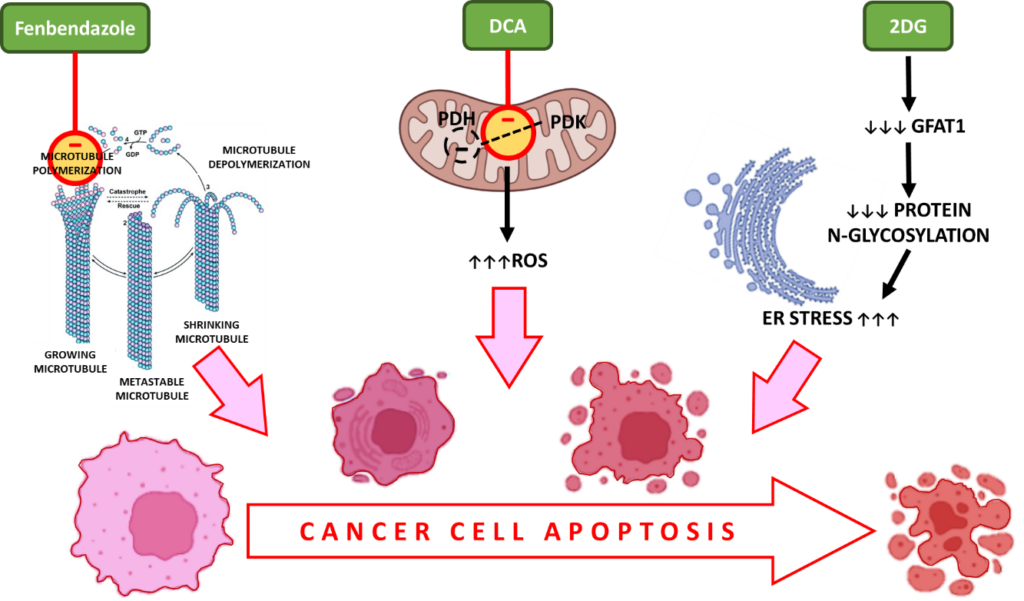
i. Фенбендазол — взаимодействует с β-тубулином, препятствуя его полимеризации с образованием микротрубочек, что приводит к остановке клеточного цикла и апоптотической гибели клеток
Во время деления клетки микротрубочки, состоящие из субъединиц тубулина, образуют веретена, обеспечивающие правильную сегрегацию хромосом. ФБЗ нарушает полимеризацию тубулина — важнейший этап клеточной пролиферации, обеспечивая остановку клеточного цикла в активно делящихся раковых клетках.
Будь то ингибирование повышенного поглощения глюкозы или воздействие на микротрубочки для остановки неконтролируемого деления клеток, ФБЗ запускает апоптоз раковых клеток как общий конечный результат.
ii. DCA — увеличивает количество реактивных видов кислорода (ROS) в раковых клетках, окислительный стресс, активацию каспаз и апоптоз
Дихлорацетат (DCA) является ингибитором киназы пируватдегидрогеназы (PDK), которая фосфорилирует PDH до фосфо PDH, активного субстрата в аэробном гликолизе.13
Ингибирование PDK и активация PDH, как сообщается, связаны с повышенной продукцией реактивных видов кислорода (ROS). ROS вызывают двунитевые разрывы в ДНК раковых клеток и повышают их чувствительность к лучевой терапии и апоптозу.
iii. 2-ДГ — лишает раковые клетки питательных веществ, вызывает окислительный стресс и апоптотическую гибель клеток
Поскольку 2DG имитирует условия недостатка глюкозы, он подавляет аэробный гликолиз, что в конечном итоге приводит к лишению питательных веществ и гибели клеток.
Кроме того, GFAT1 — ген, играющий важную роль в гликозилировании белков и необходимый для метаболизма раковых клеток. Введение 2DG снижает уровень GFAT1 дозозависимым образом, что приводит к нарушению N-гликозилирования белков. Это вызывает вызванную ER-стрессом гибель раковых клеток.
Индуцирование Апоптоза В Раковых Опухолях С Помощью Фенбендазола, DCA И 2-DG
c) Как эти три препарата дополняют стандартные методы лечения рака, оказывая дополнительное синергетическое воздействие
i. Фенбендазол — имеет низкий профиль побочных эффектов, поэтому его легко назначать совместно с традиционными методами лечения и получать синергетический эффект
Другим важным аспектом ФБЗ является его высокий запас прочности, низкая токсичность и минимальная лекарственная устойчивость по сравнению с другими химиотерапевтическими агентами, такими как таксаны и алкалоиды винки, которые также нарушают полимеризацию тубулина и останавливают деление клеток, но вызывают острую токсичность у людей.
Кроме того, FBZ также демонстрирует снижение образования новых кровеносных сосудов через ангиогенез и ингибирование роста опухоли в клетках рака легких.
ii. DCA — обращает вспять устойчивость к химиотерапии и радиотерапии
Обработка DCA ингибирует киназу пируватдегидрогеназы (PDK). Снижение фосфорилирования PDH под действием PDK уменьшает фосфорилированную пируватдегидрогеназу (pPDH), снижает аэробный гликолиз, продукцию лактата и скорость внеклеточного окисления (ECAR).
Нарушая аэробный гликолиз, DCA делает раковые клетки более чувствительными к химиотерапевтическим препаратам, а повышенное содержание ROS повышает чувствительность раковых клеток к радиации. Исследование, проведенное на клетках рака легких и печени, показало, что совместное применение DCA с паклитакселом, химиотерапевтическим препаратом, увеличивает апоптотическую гибель раковых клеток.
iii. 2-DG — замедляет метаболизм раковых клеток и делает их более уязвимыми к традиционным методам лечения
Известно, что 2DG также индуцирует экспрессию тиоредоксин-взаимодействующего белка (TXNIP), который является белком-супрессором опухоли. Тем самым он повышает химиочувствительность и радиационную чувствительность раковых клеток.
Это, в свою очередь, приводит к увеличению апоптотической гибели клеток в ответ на эти традиционные методы лечения. Таким образом, 2-DG действует как сенсибилизатор химиотерапии и лучевой терапии в раковых клетках
Борьба С Раком С Помощью Фенбендазола, DCA И 2-DG Для Преодоления Метаболического Перепрограммирования
Преобладающая в настоящее время парадигма лечения рака во многом зависит от хирургического вмешательства, лучевой терапии и химиотерапии. Этот традиционно используемый комбинированный подход во многих случаях успешно препятствует прогрессированию рака, а в некоторых случаях даже приводит к эффективному излечению пациентов.
Однако для тех пациентов, у которых диагноз был поставлен на поздних и/или метастатических стадиях заболевания, или для тех, кто, к сожалению, прогрессирует до поздних и/или метастатических стадий заболевания, вышеуказанный комбинированный подход в большинстве случаев оказывается неэффективным. Причина в том, что раковые клетки, столкнувшись с неизбежной гибелью в результате терапевтического давления, довольно часто могут адаптироваться с помощью процесса, называемого метаболическим перепрограммированием, в ходе которого они учатся дифференцированно использовать типичные источники клеточной энергии, такие как глюкоза, таким образом, чтобы сделать их устойчивыми к химиотерапии.
И до тех пор, пока на эту метаболическую адаптацию не будет направлено воздействие, лечение прогрессирующего и/или метастатического рака будет оставаться в основном неэффективным. К счастью, безопасные и эффективные препараты для преодоления метаболического перепрограммирования уже существуют и в настоящее время доступны для пациентов с раком. Три таких препарата включают фенбендазол, DCA и 2-DG, которые действуют по разным механизмам.
При комбинированном использовании они часто оказывают синергетическое действие и могут быть даже более эффективными, чем при самостоятельном применении. Кроме того, их использование не исключает применения стандартных методов лечения, таких как химиотерапия или лучевая терапия.
Исходя из имеющихся данных, можно предположить, что применение фенбендазола, DCA и/или 2-DG в сочетании с традиционными методами лечения повысит общую эффективность лечения рака, особенно при распространенном и/или метастатическом заболевании.
Перспективы На Будущее
В то время как продолжаются клинические исследования и испытания, чтобы лучше понять, как эти три препарата могут быть использованы в дальнейшем для достижения терапевтического эффекта, в настоящее время они доступны для пациентов для комбинирования в схемах лечения.
Ссылки:
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
- Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer. Nature. 2019 Nov;575(7782):299-309. doi: 10.1038/s41586-019-1730-1. Epub 2019 Nov 13. PMID: 31723286; PMCID: PMC8008476.
- Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020 May 2;21(9):3233. doi: 10.3390/ijms21093233. PMID: 32370233; PMCID: PMC7247559.
- Nong S, Han X, Xiang Y, Qian Y, Wei Y, Zhang T, Tian K, Shen K, Yang J, Ma X. Metabolic reprogramming in cancer: Mechanisms and therapeutics. MedComm (2020). 2023 Mar 27;4(2):e218. doi: 10.1002/mco2.218. PMID: 36994237; PMCID: PMC10041388.
- Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
- Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
- Fu L, Jin W, Zhang J, Zhu L, Lu J, Zhen Y, Zhang L, Ouyang L, Liu B, Yu H. Repurposing non-oncology small-molecule drugs to improve cancer therapy: Current situation and future directions. Acta Pharm Sin B. 2022 Feb;12(2):532-557. doi: 10.1016/j.apsb.2021.09.006. Epub 2021 Sep 10. PMID: 35256933; PMCID: PMC8897051.
- Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep. 2018 Aug 9;8(1):11926. doi: 10.1038/s41598-018-30158-6. PMID: 30093705; PMCID: PMC6085345.
- Park D, Lee JH, Yoon SP. Anti-cancer effects of fenbendazole on 5-fluorouracil-resistant colorectal cancer cells. Korean J Physiol Pharmacol. 2022 Sep 1;26(5):377-387. doi: 10.4196/kjpp.2022.26.5.377. PMID: 36039738; PMCID: PMC9437363.
- Song B, Park EY, Kim KJ, Ki SH. Repurposing of Benzimidazole Anthelmintic Drugs as Cancer Therapeutics. Cancers (Basel). 2022 Sep 22;14(19):4601. doi: 10.3390/cancers14194601. PMID: 36230527; PMCID: PMC9559625.
- Tataranni T, Piccoli C. Dichloroacetate (DCA) and Cancer: An Overview towards Clinical Applications. Oxid Med Cell Longev. 2019 Nov 14;2019:8201079. doi: 10.1155/2019/8201079. PMID: 31827705; PMCID: PMC6885244.
- Parczyk J, Ruhnau J, Pelz C, Schilling M, Wu H, Piaskowski NN, Eickholt B, Kühn H, Danker K, Klein A. Dichloroacetate and PX-478 exhibit strong synergistic effects in a various number of cancer cell lines. BMC Cancer. 2021 Apr 30;21(1):481. doi: 10.1186/s12885-021-08186-9. PMID: 33931028; PMCID: PMC8086110.
- O’Neill S, Porter RK, McNamee N, Martinez VG, O’Driscoll L. 2-Deoxy-D-Glucose inhibits aggressive triple-negative breast cancer cells by targeting glycolysis and the cancer stem cell phenotype. Sci Rep. 2019 Mar 7;9(1):3788. doi: 10.1038/s41598-019-39789-9. PMID: 30846710; PMCID: PMC6405919.
- Pajak B, Siwiak E, Sołtyka M, Priebe A, Zieliński R, Fokt I, Ziemniak M, Jaśkiewicz A, Borowski R, Domoradzki T, Priebe W. 2-Deoxy-d-Glucose and Its Analogs: From Diagnostic to Therapeutic Agents. Int J Mol Sci. 2019 Dec 29;21(1):234. doi: 10.3390/ijms21010234. PMID: 31905745; PMCID: PMC6982256.
- Zhang D, Li J, Wang F, Hu J, Wang S, Sun Y. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014 Dec 28;355(2):176-83. doi: 10.1016/j.canlet.2014.09.003. Epub 2014 Sep 10. PMID: 25218591.