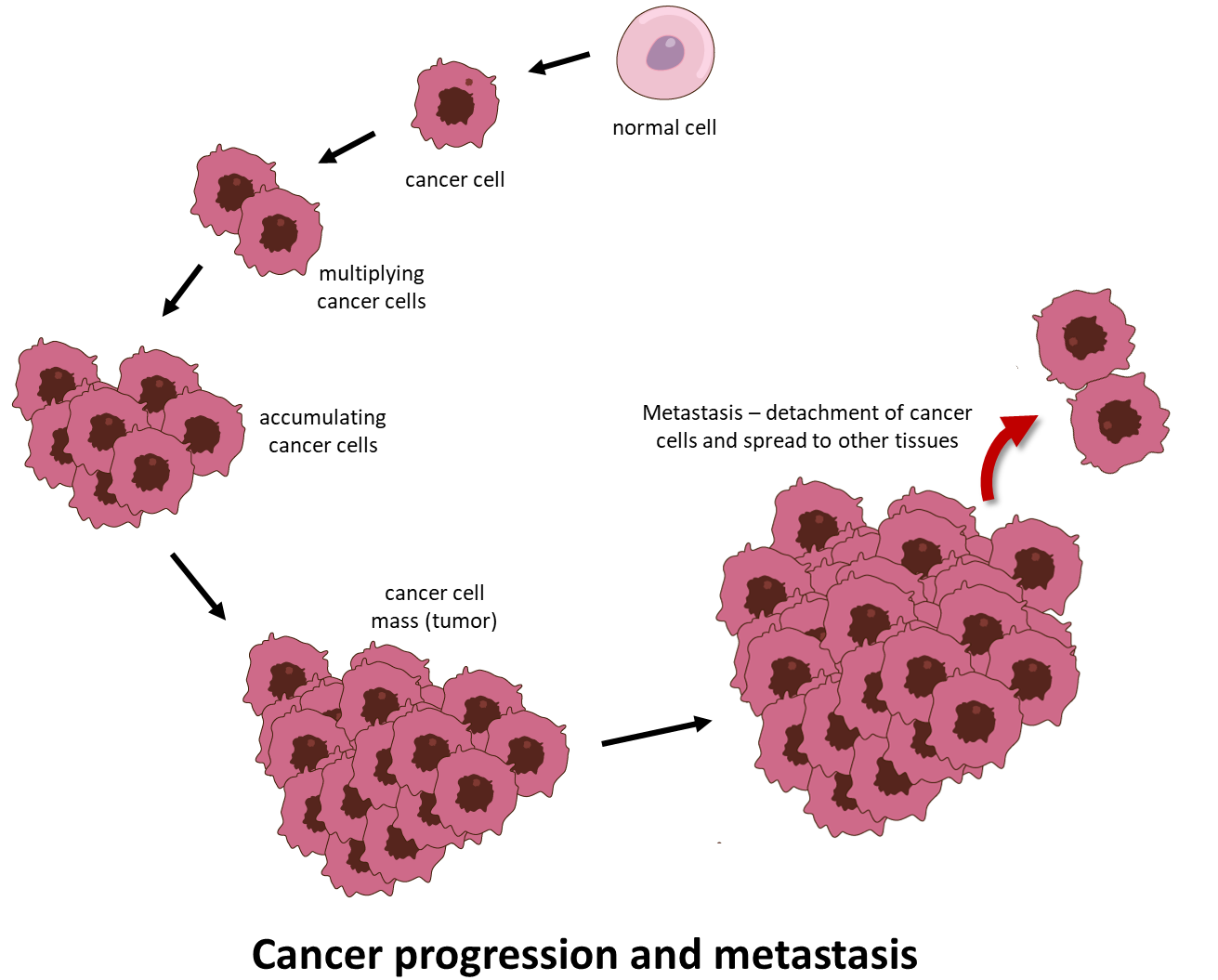
Kanker is een uitputtende ziekte waarbij abnormale cellen zich ongecontroleerd delen en het vermogen krijgen om zich buiten de plaats van oorsprong te verspreiden, waarbij ze infiltreren in en vernietiging van afgelegen lichaamsweefsels en organen. Dit laatste proces wordt metastase genoemd en is de meest voorkomende doodsoorzaak als gevolg van kanker (afbeelding 1).
In 2020 werden wereldwijd 19,3 miljoen nieuwe gevallen van kanker gerapporteerd, waarvan naar schatting 10,0 miljoen sterfgevallen.1 Het aantal kankergevallen blijft toenemen, net als het aantal sterfgevallen als gevolg van kanker. Snelle vooruitgang in het kankeronderzoek in de afgelopen vijf decennia heeft het feit aan het licht gebracht dat kankercellen tijdens de tumorigenese veranderingen in de celfysiologie verwerven die hen onderscheiden van normale cellen. Deze verworven eigenschappen, ook wel bekend als de kenmerken van kanker (figuur 2) worden door alle soorten kanker gedeeld.2 Deze gedeelde kenmerken zijn onder andere:
- Zelfvoorziening in groeisignalen. In tegenstelling tot normale cellen zijn kankercellen voor actieve proliferatie niet afhankelijk van exogene groeifactoren. In plaats daarvan verwerven ze het vermogen om groeifactoren te synthetiseren waarop ze reageren, waardoor een positieve-feedback-signaleringslus ontstaat.
- Ontwijking van groeiremmers. In tegenstelling tot normale cellen, waarin meerdere anti-proliferatieve oplosbare groeiremmers werken om cellulaire rust en weefselhomeostase te handhaven, leren kankercellen op de een of andere manier om anti-proliferatieve signalen te omzeilen die de celgroei afremmen. Kankercellen blijven daarom prolifereren, zelfs in aanwezigheid van groeiremmers.
- Weerstand tegen celdood. Kankercellen verzetten zich tegen natuurlijke celdoodroutes die onnodige of potentieel gevaarlijke cellen elimineren.
- Angiogenese. Kankercellen laten snel bloedvaten groeien via angiogenese om verbinding te maken met de bloedsomloop en zo toegang te krijgen tot zuurstof en voedingsstoffen om te overleven en zich te vermenigvuldigen.
- Invasie en metastase. Kankercellen verplaatsen zich van de primaire locatie naar afgelegen locaties a) om immuunsurveillance te omzeilen, b) om een gebrek aan zuurstof en noodzakelijke voedingsstoffen te overwinnen als gevolg van de grote omvang van de tumor, c) om te ontsnappen aan celdood veroorzaakt door ophoping van overtollig melkzuur.
- Immuunontwijking. Tumoren kunnen aanvallen van het immuunsysteem omzeilen door verschillende mechanismen, zoals het beperken van de herkenning van antigenen, d.w.z. het immuunsysteem misleiden om malafide kankercellen niet te herkennen, en het uitputten van T-cellen, de soldaten van het immuunsysteem die malafide kankercellen herkennen.
- Tumorbevorderende ontsteking. In een normale ontstekingsreactie produceren immuuncellen chemische stoffen die een ziekteverwekker doden. Deze chemische stoffen, bekend als reactieve zuurstofspecies, kunnen ook het DNA van normale cellen beschadigen, wat op zijn beurt het risico op mutaties verhoogt en vervolgens de ontwikkeling van kanker stimuleert als gevolg van chronische ontsteking.
- Mutatie(s) en genomische instabiliteit. Dit komt door de verhoogde neiging tot genoomverandering tijdens de celdeling. Afwijkende DNA replicatie draagt bij tot het verkrijgen van mutatie(s) en een instabiel genoom, wat op zijn beurt leidt tot de ontwikkeling van maligniteit.
- Epigenetische herprogrammering. Dit zijn veranderingen in de onderliggende chromatinestructuur van een gen. Dergelijke veranderingen kunnen een kankerveroorzakend oncogen inschakelen of een tumorsuppressorgen uitschakelen en het proces van tumorgenese ondersteunen.
- Polymorfe genomen. Of genetische variaties in genen die DNA-mismatchreparatie, celcyclusregulatie, metabolisme en immuniteit regelen, verhogen de vatbaarheid voor kanker.
- Fenotypische plasticiteit. Het vermogen van kankercellen om dynamische veranderingen te ondergaan in de vorm, grootte, morfologie enz. helpt bij het ontwijken van het immuunsysteem en het resistent worden tegen geneesmiddelen en bevordert de invasie en verre migratie van kankercellen.
- Metabolische herprogrammering. Het vermogen van kankercellen om hun metabolisme te veranderen om aan de verhoogde energiebehoefte van snel groeiende kankercellen te voldoen en zo ‘onsterfelijk’ te worden.
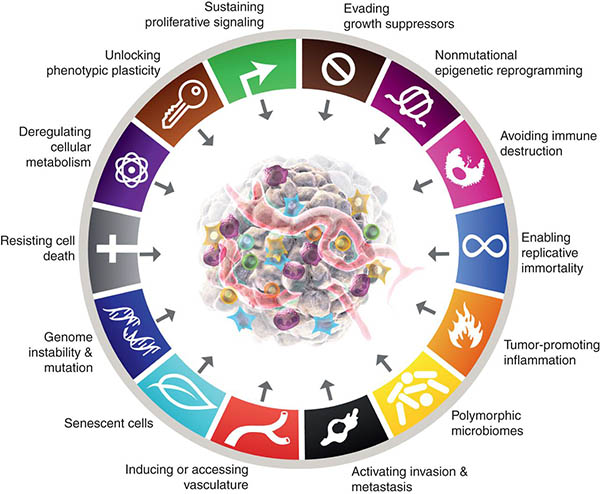
De Kenmerken Van Kanker
(Afbeelding met dank aan Cancer Discovery Journal https://www.aacr.org/blog/2022/01/21/new-dimensions-in-cancer-biology-updated-hallmarks-of-cancer-published/)
Huidige Uitdagingen Om De Juiste Kankerbehandeling Te Vinden
Aangezien er meerdere mogelijke factoren zijn die de transformatie van normale cellen tot kwaadaardige kankercellen stimuleren, blijft preventie erg moeilijk en vormt het uitroeien van kanker, als deze zich eenmaal heeft gevestigd, nog steeds een groot aantal uitdagingen. Conventionele kankertherapie, waaronder chemotherapie en bestraling, richt zich voornamelijk op actief prolifererende cellen.
Chemotherapeutische medicijnen maken geen onderscheid tussen actief delende normale cellen en kankercellen. Daarom worden ernstige toxische effecten waargenomen bij patiënten als gevolg van onbedoeld maar onvermijdelijk verlies van normale cellen. Dit resulteert in neurotoxiciteit, cardiotoxiciteit, gastro-intestinale toxiciteit en immuunsuppressie. Bovendien worden chemotherapeutische geneesmiddelen vaak geassocieerd met resistentie.3,4
Daarom hebben veel kankerpatiënten bij wie de ziekte na een korte remissie terugkeert, dringend behoefte aan alternatieve medicijnen die ook andere kenmerken van kanker aanpakken en minder toxiciteit veroorzaken.
Metabolische Herprogrammering: De Belangrijkste Reden Waarom Bestaande Kankertherapieën Falen
Glucose is de belangrijkste energiebron voor normale, eukaryote, niet-kankercellen. Tijdens het glucosemetabolisme produceren normale cellen CO2 via oxidatieve fosforylering onder aerobe omstandigheden of lactaat via glycolyse onder anaerobe omstandigheden. In kankercellen speelt de metabolische verschuiving naar overmatige glucoseconsumptie – meer dan 200 keer de normale snelheid, bekend als aerobe glycolyse of het Warburg-effect – een centrale rol.5,6
In tegenstelling tot normale weefsels, waar cellen alleen glycolyse vertonen onder zuurstofbeperkte of anerobe omstandigheden, herprogrammeren kankercellen de metabolische route om zelfs in aerobe omstandigheden glycolyse uit te voeren om te voldoen aan de hoge energiebehoefte van ongecontroleerde celdeling; dit wordt het Warburg effect of aerobe glycolyse genoemd en is een kritieke eigenschap die kankercellen onderscheidt van normale cellen.
Deze metabolische verandering leidt tot een overproductie van lactaat, dat vervolgens uit de cellen wordt gedreven. Deze uitdrijving leidt tot melkzuuraccumulatie, wat de verzuring van de tumormicro-omgeving bevordert, een toestand die het immuunsysteem kan onderdrukken en mogelijk de werkzaamheid van bepaalde immunotherapiebehandelingen kan verminderen.
Waarom Zijn Suikerarme/Ketogene Diëten Niet Effectief?
Bovendien zijn strategieën zoals ketogeen diëten of het vermijden van suiker over het algemeen niet effectief in deze context. Deze benaderingen versnellen vaak cachexie, een ernstige vorm van spier- en gewichtsverlies, waardoor de progressie naar sterfte wordt versneld. 7
Deze ineffectiviteit is voornamelijk te wijten aan het feit dat kankercellen bedreven zijn in het onttrekken van essentiële voedingsstoffen uit spieren (met name glutamine) en andere weefsels voor hun levensonderhoud, waardoor het beoogde effect van dieetbeperkingen wordt ondermijnd.
Medicijnen Tegen Kanker Opnieuw Gebruiken
De ontwikkeling van nieuwe medicijnen tegen kanker wordt steeds moeilijker en kostbaarder. Om een effectieve therapeutische behandeling voor kanker te vinden, blijken medicijnen die al klinisch zijn goedgekeurd of experimenteel zijn getest voor andere aandoeningen dan kanker, maar die een tot nu toe niet erkende cytotoxiciteit voor kwaadaardige cellen blijken te bezitten, zeer nuttig te zijn.
Kankeronderzoekers hebben bepaalde medicijnmoleculen geïdentificeerd die kunnen dienen als geschikte kandidaten tegen kanker naast conventionele therapieën. Daarom kan het hergebruiken van geneesmiddelen die werkzaam zijn tegen kanker worden beschouwd als een belangrijke strategie voor kankertherapie.8
Vanwege het hierboven beschreven mechanisme van metabole herprogrammering waardoor standaard kankertherapieën meestal falen, zou het het meest zinvol zijn om ons te richten op nieuwe kandidaat-geneesmiddelen die juist dit mechanisme bestrijden. Hoewel er dus veel veelbelovende kandidaat-geneesmiddelen bestaan om de bestaande kankerbestrijdingstherapieën aan te vullen, is er een sterke reden om ons te richten op geneesmiddelen die één specifiek kenmerk van kanker in het bijzonder tegengaan: metabole herprogrammering.
Geneesmiddelen Die Helpen Metabolische Herprogrammering Bij Kanker Te Overwinnen: Fenbendazol, natriumdichlooracetaat (DCA) en 2-deoxy-d-glucose (2-DG)
a) Hoe de 3 geneesmiddelen unieke, onafhankelijke en synergetische mechanismen hebben om overmatig glucoseverbruik in kankercellen te bestrijden:
i. Fenbendazol – vermindert GLUT-transporters en beïnvloedt hexokinase 2
Fenbendazol (FBZ) (methyl-N-(6-fenylsulfanyl-1H-benzimidazol-2-yl) carbamaat) is een klasse van benzimidazolen die gebruikt wordt als een geneesmiddel tegen kanker. FBZ heeft een bewezen antikankereffect omdat het de celproliferatie stopt, de glucoseopname verlaagt en apoptotische celdood veroorzaakt.9 ,10,11
Hergebruik van fenbendazol is daarom een belangrijke optie in kankertherapie die de aanzienlijke tijd en kosten die nodig zijn om nieuwe geneesmiddelen te ontwikkelen kan verminderen.
Kanker wordt geassocieerd met een stofwisselingsstoornis waarbij de kankercellen selectief de voorkeur geven aan inefficiënte aerobe glycolyse (die slechts 2 moleculen ATP genereert) boven mitochondriale oxidatieve fosforylering (die 38 moleculen ATP genereert) om aan hun energiebehoefte te voldoen. Aërobe glycolyse is een inefficiënt energieproces, dus moeten de kankercellen hun glucoseverbruik met een veelvoud verhogen.
Kankercellen verhogen de opname van glucose door GLUT1 te upreguleren, een membraaneiwit dat de basale opname van glucose vergemakkelijkt. Behandeling met FBZ resulteert in een verminderde glucose-opname in kankercellen door de downregulatie van GLUT-transporters en andere belangrijke glycolytische enzymen zoals Hexokinase II (HKII).
Om aerobe glycolyse aan te sturen, worden veel glycolytische enzymen tijdens tumorigenese omhooggereguleerd. Hexokinase II (HKII), een belangrijk glycolytisch enzym, speelt een cruciale rol in glucosebehoud en metabolisme door glucose te fosforyleren tot glucose-6-fosfaat, dat vervolgens in de glycolyse terecht kan komen.
HKII is dus een zeer gunstig enzym voor de overleving en proliferatie van kankercellen. FBZ schaadt de enzymatische functie van HKII in kankercellen wat leidt tot verminderde glucose retentie in met FBZ behandelde cellen, uiteindelijk sterven de kankercellen omdat ze glucose niet kunnen gebruiken als energiebron via aerobe glycolyse. 11
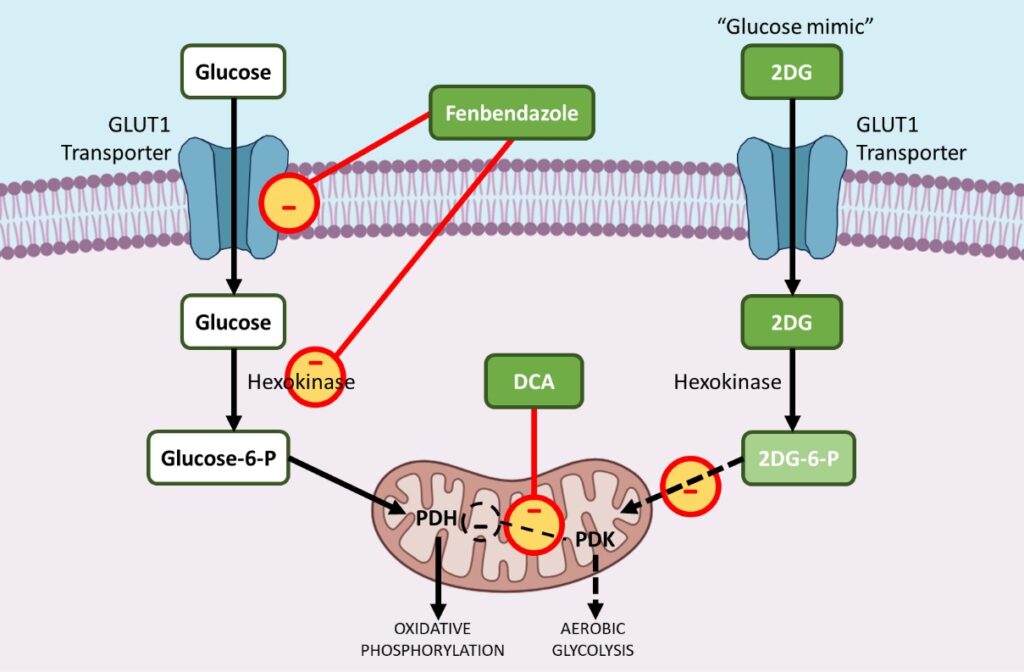
Metabole Programmering In Kanker Overwinnen Met Fenbendazol, DCA En 2-DG
ii. DCA – remt pyruvaatdehydrogenase kinase (PDK)
Sodium dichloroacetate (DCA), een kleine molecule die al wordt gebruikt voor de behandeling van acute en chronische melkzuuracidose, is grotendeels opnieuw gebruikt als geneesmiddel tegen kanker.12,13
Kankercellen halen energie uit overmatige glycolyse in plaats van mitochondriale oxidatieve fosforylering. Door de aerobe glycolyse te stimuleren en de zuurgraad van de tumormicroomgeving te verhogen, hebben kankercellen een duidelijk voordeel. Metabole acidose in de tumor micro-omgeving remt apoptose of natuurlijke celdood mechanismen en helpt bij het opbouwen van resistentie tegen medicijnen.
Tijdens carcinogenese worden de meeste glycolytische enzymen verhoogd terwijl enzymen die helpen bij oxidatieve fosforylering in mitochondria bij voorkeur worden verlaagd. Pyruvaat dehydrogenase kinase (PDK) is een poortwachtersenzym dat de stroom van glucose naar de mitochondriën regelt, waar oxidatieve fosforylering plaatsvindt. In aanwezigheid van geactiveerd PDK wordt pyruvaatdehydrogenase (PDH), een pro-oxidatief fosforylatie-enzym, geremd, waardoor de instroom van pyruvaat in de mitochondria, waar glucoseoxidatie kan plaatsvinden, wordt beperkt.
Hierdoor verschuift het metabolisme in de richting van glycolyse. DCA richt zich selectief op kankercellen die hun metabolisme verschuiven van glycolyse naar oxidatieve fosforylering door remming van pyruvaat dehydrogenase kinase (PDK), de remmer van pyruvaat dehydrogenase (PDH).
De activering van PDH-enzymen bevordert oxidatieve fosforylering in plaats van aerobe glycolyse, de voorkeursroute waarmee kankercellen aan deze hoge energiebehoefte voldoen, waardoor het metabole voordeel van kankercellen wordt verstoord en de kankercellen gevoeliger worden voor chemotherapeutische medicijnen.
iii. 2-DG – een glucoseanaloog of ‘nabootser’ die sleutelenzymen zoals hexokinase en glucose-6-fosfaatisomerase blokkeert
2-deoxy-D-glucose (2-DG)is een natuurlijk, niet-metaboliseerbaar glucoseanaloog waarvan de 2-hydroxylgroep is vervangen door waterstof. 2DG remt de glucoseopname competitief, omdat glucose en 2-DG beide in de cel worden getransporteerd door het glucosetransportenzym (GLUT1). 14,15,16
Wanneer er minder glucose in de kankercel wordt getransporteerd, kan er minder aerobe glycolyse plaatsvinden. Vermindering van de glycolyse stopt uiteindelijk de actieve celdeling van de kankercellen.
Ten tweede fosforyleert hexokinase na binnenkomst in de cel zowel glucose als 2DG tot respectievelijk glucose-6-fosfaat en 2-Deoxy-D-glucose-6-fosfaat (2DG-6-P).
2DG-6-P kan niet verder worden gemetaboliseerd via glycolyse. Als zodanig remt het competitief de productie van glucose-6-fosfaat uit glucose tijdens de glycolyse en remt zo het glucosemetabolisme in kankercellen.
b) Hoe de 3 geneesmiddelen unieke, onafhankelijke en synergetische mechanismen hebben om selectieve apoptose in kankercellen te induceren, maar niet in normale cellen
i. Fenbendazole – interacts with β-tubulin to prevent polymerization to form microtubules leading to cell cycle arrest and apoptotic celli. Fenbendazool – heeft een wisselwerking met β-tubuline om polymerisatie tot microtubuli te voorkomen, wat leidt tot celcyclusstilstand en apoptotische celdood.
Tijdens de celdeling vormen microtubuli, die gemaakt zijn van tubuline subeenheden, spindels om een correcte chromosomale scheiding mogelijk te maken. FBZ verstoort de tubulinepolymerisatie, een essentiële stap tijdens de celproliferatie, waardoor de celcyclus in actief delende kankercellen wordt gestopt.
Of het nu gaat om het remmen van verhoogde opname van glucose of het richten van microtubuli om ongecontroleerde celdeling te stoppen, FBZ triggert kankercelapoptose als een gemeenschappelijk eindresultaat.
ii. DCA – verhoogt de reactieve zuurstofsoorten (ROS) in kankercellen, oxidatieve stress, caspase-activatie en apoptose
Dichloroacetate (DCA) Dichlooracetaat (DCA) is een remmer van het pyruvaat dehydrogenase kinase (PDK) dat PDH fosforyleert tot fosfo PDH, het actieve substraat in aerobe glycolyse.13
De remming van PDK en activering van PDH worden in verband gebracht met een verhoogde productie van reactieve zuurstofsoorten (ROS). ROS induceren dubbelstrengsbreuken in het DNA van kankercellen en vergroten hun gevoeligheid voor bestralingstherapie en apoptose.
iii. 2-DG – ontneemt kankercellen voedingsstoffen, veroorzaakt oxidatieve stress en apoptotische celdood
Omdat 2DG de omstandigheden van glucosetekort nabootst, remt het de aerobe glycolyse, wat uiteindelijk leidt tot een tekort aan voedingsstoffen en celdood.
Verder is GFAT1 een gen dat een belangrijke rol speelt bij eiwitglycosylering en essentieel is voor het metabolisme van kankercellen. Toediening van 2DG vermindert GFAT1 op een dosisafhankelijke manier, wat leidt tot verstoring van de N-glycosylering van eiwitten. Dit veroorzaakt ER-stress-geïnduceerde celdood van kankercellen.
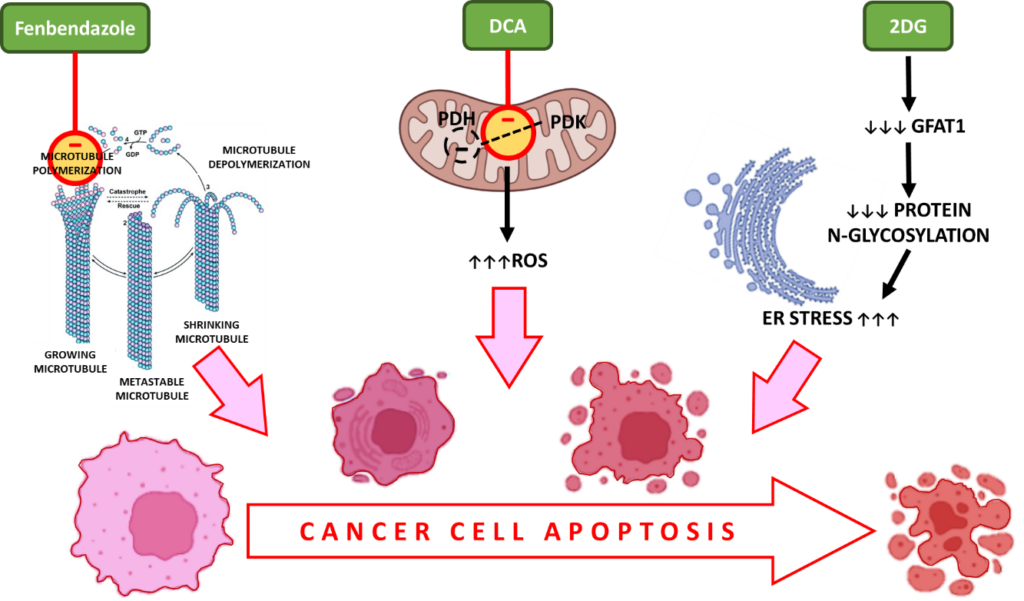
Apoptose In Kanker Induceren Met Fenbendazol, DCA En 2-DG
c) Hoe de 3 geneesmiddelen de standaard kankerbehandelingen aanvullen om verdere synergetische effecten uit te oefenen
i. Fenbendazol – laag bijwerkingenprofiel, daarom gemakkelijk in combinatie met traditionele behandelingen toe te dienen en synergetische effecten te verkrijgen
Een ander belangrijk aspect van FBZ is de hoge veiligheidsmarge, lage toxiciteit en minimale resistentie tegen geneesmiddelen in vergelijking met andere chemotherapeutische middelen zoals taxanen en vinca-alkaloïden die ook de tubulinepolymerisatie verstoren en de celdeling stoppen, maar acute toxiciteit veroorzaken bij mensen.
Daarnaast laat FBZ ook een vermindering zien in de vorming van nieuwe bloedvaten via angiogenese en remming van tumorgroei in longkankercellen.
ii. DCA – keert resistentie tegen chemotherapie en radiotherapie om
Behandeling met DCA remt pyruvaatdehydrogenase kinase (PDK). Afname van PDH-fosforylering door PDK verlaagt gefosforyleerd pyruvaatdehydrogenase (pPDH), verlaagt aerobe glycolyse, lactaatproductie en extracellulaire verzuringssnelheid (ECAR).
Door de aerobe glycolyse te verstoren maakt DCA de kankercellen gevoeliger voor chemotherapeutische middelen, terwijl verhoogde ROS de kankercellen gevoeliger maakt voor straling. Een onderzoek uitgevoerd op longkanker- en leverkankercellen toonde aan dat gelijktijdige toediening van DCA met paclitaxel, een chemotherapeutisch middel, de apoptotische celdood in kankercellen verhoogde.
iii. 2-DG – vertraagt metabolisch overactieve kankercellen en maakt ze kwetsbaarder voor traditionele behandelingen
Van 2DG is ook bekend dat het de expressie van thioredoxine interacterend eiwit (TXNIP), een tumorsuppressoreiwit, induceert. Hierdoor verhoogt het de chemosensitiviteit en stralingsgevoeligheid van de kankercellen.
Dit resulteert op zijn beurt in een verhoogde apoptotische celdood als reactie op deze conventionele behandelingen. Als zodanig werkt 2-DG als een chemotherapie en bestralingstherapie sensitizer in kankercellen.
Kanker Bestrijden Met Fenbendazol, DCA En 2-DG Om Metabole Herprogrammering Te Overwinnen
Het momenteel gangbare paradigma voor de behandeling van kanker is grotendeels afhankelijk van chirurgie, bestralingstherapie en chemotherapie. Deze traditioneel toegepaste combinatiebenadering is in veel gevallen succesvol geweest in het tegengaan van de progressie van kanker en is in sommige gevallen zelfs succesvol geweest in het effectief genezen van patiënten.
Echter, voor patiënten die gediagnosticeerd worden in een vergevorderd en/of metastatisch ziektestadium, of patiënten die helaas vorderen naar een vergevorderd en/of metastatisch ziektestadium, is de bovenstaande combinatiebenadering grotendeels ineffectief. De reden hiervoor is dat kankercellen, wanneer ze geconfronteerd worden met een dreigende dood als gevolg van therapeutische druk, zich vaak kunnen aanpassen door middel van een proces dat metabole herprogrammering wordt genoemd en waarbij ze leren om typische bronnen van celenergie, zoals glucose, anders te gebruiken op een manier die hen resistent maakt tegen chemotherapie.
En totdat deze metabole aanpassing wordt aangepakt, zullen behandelingen voor gevorderde en/of uitgezaaide kankers grotendeels ineffectief blijven. Gelukkig bestaan er al veilige en effectieve medicijnen om metabole herprogrammering tegen te gaan en deze zijn momenteel beschikbaar voor kankerpatiënten. Drie van deze medicijnen zijn Fenbendazol, DCA en 2-DG, die elk afzonderlijk via verschillende mechanismen werken.
Wanneer ze in combinatie worden gebruikt, hebben ze vaak een synergetisch effect en kunnen ze zelfs effectiever zijn dan wanneer ze op zichzelf staan. Bovendien sluit het gebruik ervan het gebruik van standaardbehandelingen zoals chemotherapie of bestralingstherapie niet uit.
Op basis van de beschikbare gegevens wordt voorspeld dat toediening van fenbendazol, DCA en/of 2-DG in combinatie met traditionele behandelingen de algehele effectiviteit van de behandeling van kanker zal verbeteren, met name in de gevorderde en/of uitgezaaide fase.
Toekomstperspectief
Hoewel er klinische studies en onderzoeken worden uitgevoerd om beter te begrijpen hoe deze 3 geneesmiddelen verder kunnen worden gebruikt voor therapeutisch voordeel, zijn ze momenteel beschikbaar voor patiënten om te worden gecombineerd in behandelingsschema’s.
Referenties:
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
- Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer. Nature. 2019 Nov;575(7782):299-309. doi: 10.1038/s41586-019-1730-1. Epub 2019 Nov 13. PMID: 31723286; PMCID: PMC8008476.
- Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020 May 2;21(9):3233. doi: 10.3390/ijms21093233. PMID: 32370233; PMCID: PMC7247559.
- Nong S, Han X, Xiang Y, Qian Y, Wei Y, Zhang T, Tian K, Shen K, Yang J, Ma X. Metabolic reprogramming in cancer: Mechanisms and therapeutics. MedComm (2020). 2023 Mar 27;4(2):e218. doi: 10.1002/mco2.218. PMID: 36994237; PMCID: PMC10041388.
- Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
- Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
- Fu L, Jin W, Zhang J, Zhu L, Lu J, Zhen Y, Zhang L, Ouyang L, Liu B, Yu H. Repurposing non-oncology small-molecule drugs to improve cancer therapy: Current situation and future directions. Acta Pharm Sin B. 2022 Feb;12(2):532-557. doi: 10.1016/j.apsb.2021.09.006. Epub 2021 Sep 10. PMID: 35256933; PMCID: PMC8897051.
- Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep. 2018 Aug 9;8(1):11926. doi: 10.1038/s41598-018-30158-6. PMID: 30093705; PMCID: PMC6085345.
- Park D, Lee JH, Yoon SP. Anti-cancer effects of fenbendazole on 5-fluorouracil-resistant colorectal cancer cells. Korean J Physiol Pharmacol. 2022 Sep 1;26(5):377-387. doi: 10.4196/kjpp.2022.26.5.377. PMID: 36039738; PMCID: PMC9437363.
- Song B, Park EY, Kim KJ, Ki SH. Repurposing of Benzimidazole Anthelmintic Drugs as Cancer Therapeutics. Cancers (Basel). 2022 Sep 22;14(19):4601. doi: 10.3390/cancers14194601. PMID: 36230527; PMCID: PMC9559625.
- Tataranni T, Piccoli C. Dichloroacetate (DCA) and Cancer: An Overview towards Clinical Applications. Oxid Med Cell Longev. 2019 Nov 14;2019:8201079. doi: 10.1155/2019/8201079. PMID: 31827705; PMCID: PMC6885244.
- Parczyk J, Ruhnau J, Pelz C, Schilling M, Wu H, Piaskowski NN, Eickholt B, Kühn H, Danker K, Klein A. Dichloroacetate and PX-478 exhibit strong synergistic effects in a various number of cancer cell lines. BMC Cancer. 2021 Apr 30;21(1):481. doi: 10.1186/s12885-021-08186-9. PMID: 33931028; PMCID: PMC8086110.
- O’Neill S, Porter RK, McNamee N, Martinez VG, O’Driscoll L. 2-Deoxy-D-Glucose inhibits aggressive triple-negative breast cancer cells by targeting glycolysis and the cancer stem cell phenotype. Sci Rep. 2019 Mar 7;9(1):3788. doi: 10.1038/s41598-019-39789-9. PMID: 30846710; PMCID: PMC6405919.
- Pajak B, Siwiak E, Sołtyka M, Priebe A, Zieliński R, Fokt I, Ziemniak M, Jaśkiewicz A, Borowski R, Domoradzki T, Priebe W. 2-Deoxy-d-Glucose and Its Analogs: From Diagnostic to Therapeutic Agents. Int J Mol Sci. 2019 Dec 29;21(1):234. doi: 10.3390/ijms21010234. PMID: 31905745; PMCID: PMC6982256.
- Zhang D, Li J, Wang F, Hu J, Wang S, Sun Y. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014 Dec 28;355(2):176-83. doi: 10.1016/j.canlet.2014.09.003. Epub 2014 Sep 10. PMID: 25218591.