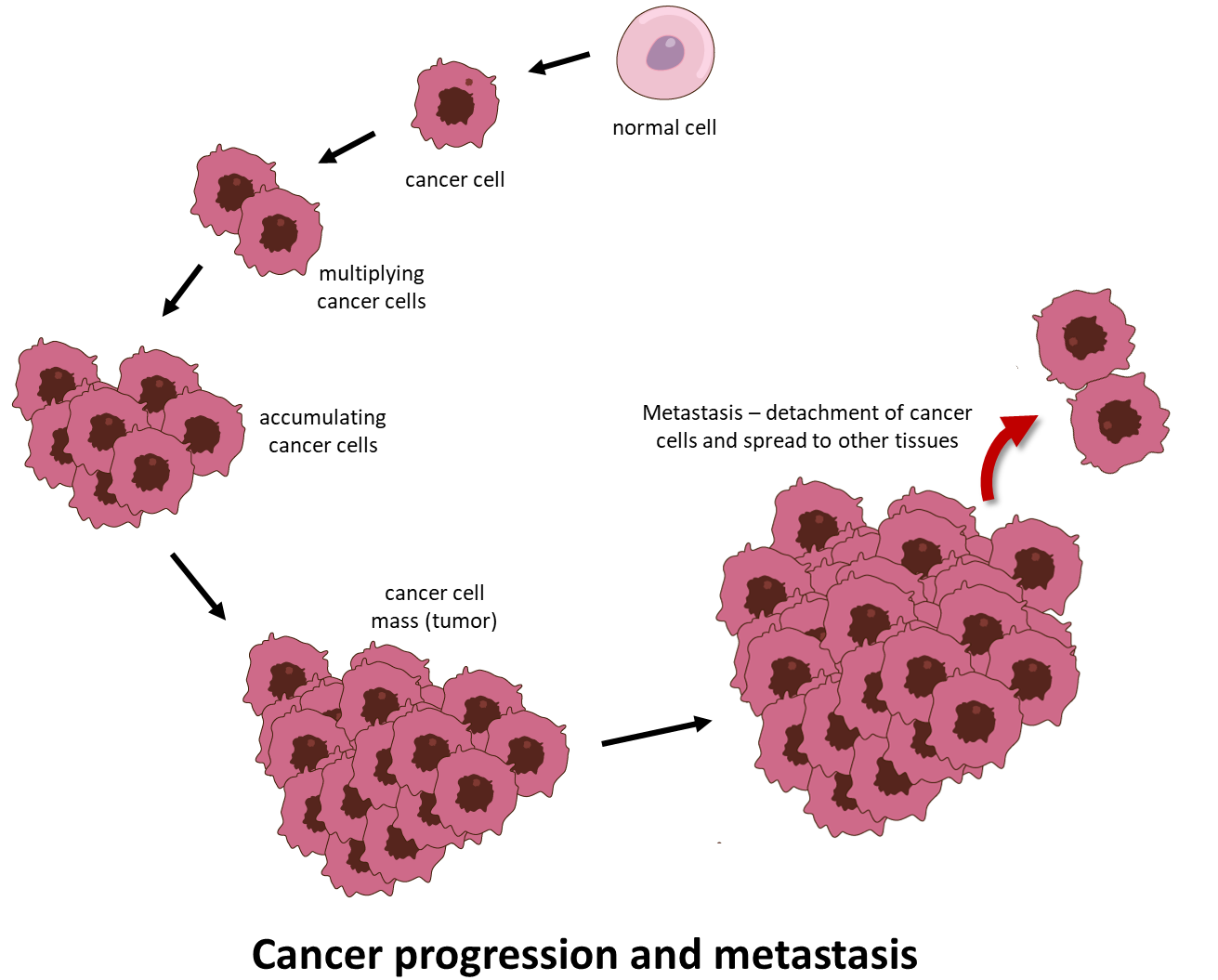
Le cancer est une maladie décourageante dans laquelle des cellules anormales se divisent de manière incontrôlée et acquièrent la capacité de se propager au-delà de leur site d’origine, en infiltrant et en détruisant des tissus et des organes éloignés. Ce dernier processus, appelé métastase, est la cause la plus fréquente de décès lié au cancer (Figure 1).
En 2020, 19,3 millions de nouveaux cas de cancer ont été signalés dans le monde, dont un nombre stupéfiant de 10 millions de décès.1 L’incidence du cancer continue d’augmenter, de même que l’incidence des décès liés au cancer. Les progrès rapides de la recherche sur le cancer au cours des cinq dernières décennies ont révélé que pendant la tumorigenèse, les cellules cancéreuses acquièrent des altérations de la physiologie cellulaire qui les différencient des cellules normales. Ces capacités acquises, également connues sous le nom de « caractéristiques du cancer » (Figure 2) sont communes à tous les types de cancer.2 Ces caractéristiques communes sont notamment les suivantes:
- Autosuffisance en signaux de croissance. Contrairement aux cellules normales, les cellules cancéreuses ne dépendent pas de facteurs de croissance exogènes pour leur prolifération active. Au contraire, elles acquièrent la capacité de synthétiser les facteurs de croissance auxquels elles répondent, créant ainsi une boucle de signalisation à rétroaction positive.
- Évasion des suppresseurs de croissance. Contrairement aux cellules normales, dans lesquelles de multiples inhibiteurs de croissance solubles anti-prolifératifs agissent pour maintenir la quiescence cellulaire et l’homéostasie tissulaire, les cellules cancéreuses apprennent d’une manière ou d’une autre à échapper aux signaux anti-prolifératifs qui ralentissent la croissance cellulaire. Les cellules cancéreuses continuent donc à proliférer même en présence de suppresseurs de croissance.
- Résistance à la mort cellulaire. Les cellules cancéreuses s’opposent aux voies naturelles de mort cellulaire qui éliminent les cellules inutiles ou potentiellement dangereuses.
- Angiogenèse. Les cellules cancéreuses développent rapidement des vaisseaux sanguins par angiogenèse pour se connecter au système circulatoire et accéder à l’oxygène et aux nutriments nécessaires à leur survie et à leur prolifération.
- Invasion and metastasis. Cancer cells transfer from the primary site to distant locations a) to evade immune surveillance, b) to overcome lack of oxygen and necessary nutrients due to large tumor size, c) to escape cell death caused by accumulation of excess lactic acid.
- Invasion et métastases. Les cellules cancéreuses se déplacent du site primaire vers des sites distants a) pour échapper à la surveillance immunitaire, b) pour surmonter le manque d’oxygène et de nutriments nécessaires dû à la taille importante de la tumeur, c) pour échapper à la mort cellulaire causée par l’accumulation d’un excès d’acide lactique.
- Inflammation favorisant les tumeurs. Lors d’une réponse inflammatoire normale, les cellules immunitaires produisent des substances chimiques qui tuent l’agent pathogène. Ces substances chimiques, connues sous le nom d’espèces réactives de l’oxygène, peuvent également endommager l’ADN des cellules normales, ce qui augmente le risque de mutations et favorise ensuite le développement de cancers dus à l’inflammation chronique.
- Mutation(s) et instabilité génomique. Ce phénomène est dû à la tendance accrue à l’altération du génome au cours de la division cellulaire. Une réplication aberrante de l’ADN contribue à l’acquisition de mutations et d’un génome instable, ce qui entraîne le développement d’une tumeur maligne.
- Reprogrammation épigénétique. Il s’agit de modifications de la structure chromatinienne sous-jacente d’un gène. Ces changements peuvent activer un oncogène cancérigène ou désactiver un gène suppresseur de tumeur et favoriser le processus de tumorigenèse.
- Les génomes polymorphes. Les variations génétiques dans les gènes qui régulent la réparation des erreurs d’appariement de l’ADN, la régulation du cycle cellulaire, le métabolisme et l’immunité augmentent la susceptibilité au cancer.
- Plasticité phénotypique. La capacité des cellules cancéreuses à subir des changements dynamiques de forme, de taille, de morphologie, etc. contribue à l’évasion immunitaire et à la résistance aux médicaments et favorise l’invasion et la migration à distance des cellules cancéreuses.
- Reprogrammation métabolique. Capacité des cellules cancéreuses à modifier leur métabolisme pour répondre à la demande énergétique accrue des cellules cancéreuses en prolifération rapide et, ce faisant, à devenir « immortelles ».
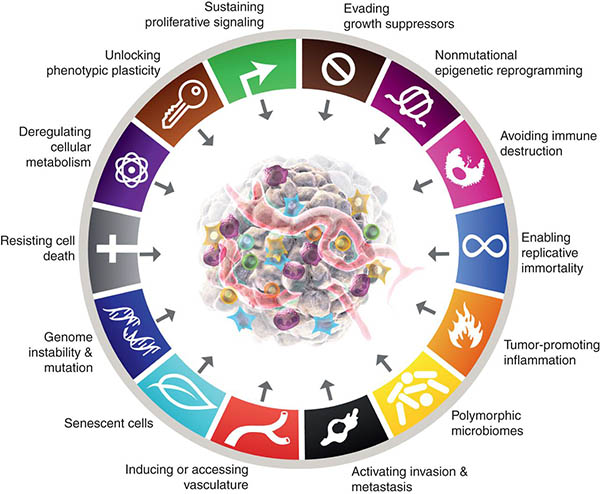
(Avec l’aimable autorisation de Cancer Discovery Journal https://www.aacr.org/blog/2022/01/21/new-dimensions-in-cancer-biology-updated-hallmarks-of-cancer-published/)
Les Défis Actuels Pour Trouver Le Bon Traitement Contre Le Cancer
Étant donné qu’il existe de multiples facteurs susceptibles d’entraîner la transformation de cellules normales en cellules cancéreuses malignes, la prévention reste très difficile et l’éradication du cancer, une fois qu’il est déjà installé, pose encore une myriade de défis. Le traitement conventionnel du cancer, y compris la chimiothérapie et la radiothérapie, cible principalement les cellules en prolifération active.
Les médicaments chimiothérapeutiques ne font pas la différence entre les cellules normales en division active et les cellules cancéreuses. Par conséquent, des effets toxiques graves sont observés chez les patients en raison de la perte involontaire mais inévitable de cellules normales. Il en résulte une neurotoxicité, une cardiotoxicité, une toxicité gastro-intestinale et une suppression immunitaire. En outre, les médicaments chimiothérapeutiques sont souvent associés à une résistance.3,4
Par conséquent, de nombreux patients atteints de cancer et dont la maladie réapparaît après une brève rémission ont un besoin urgent de médicaments alternatifs qui s’attaquent également à d’autres caractéristiques du cancer et qui sont moins toxiques.
Reprogrammation Métabolique : La Raison Principale De L’échec Des Thérapies Existantes Contre Le Cancer
Le glucose est la principale source d’énergie des cellules eucaryotes normales non cancéreuses. Au cours du métabolisme du glucose, les cellules normales produisent du CO2 par phosphorylation oxydative dans des conditions aérobies ou du lactate par glycolyse dans des conditions anaérobies. Dans les cellules cancéreuses, le changement métabolique vers une consommation excessive de glucose – plus de 200 fois le taux normal, connu sous le nom de glycolyse aérobie ou d’effet Warburg – joue un rôle central.5,6
Contrairement aux tissus normaux, où les cellules ne présentent une glycolyse que dans des conditions anaérobies ou limitées en oxygène, les cellules cancéreuses reprogramment la voie métabolique pour effectuer une glycolyse même dans des conditions aérobies afin de répondre à la forte demande d’énergie de la division cellulaire incontrôlée ; ce phénomène est appelé effet Warburg ou glycolyse aérobie et constitue une caractéristique essentielle qui distingue les cellules cancéreuses des cellules normales.
Cette altération métabolique entraîne une surproduction de lactate, qui est ensuite expulsé des cellules. Cette expulsion entraîne une accumulation d’acide lactique qui favorise l’acidification du microenvironnement tumoral, une condition qui peut supprimer le système immunitaire et potentiellement réduire l’efficacité de certains traitements d’immunothérapie.
Pourquoi les régimes pauvres en sucre et cétogènes sont-ils inefficaces?
En outre, les stratégies telles que les régimes cétogènes ou l’évitement du sucre sont généralement inefficaces dans ce contexte. Ces approches accélèrent souvent la cachexie, une forme sévère de perte de muscle et de poids, ce qui accélère la progression vers la mortalité.7
Cette inefficacité est principalement due au fait que les cellules cancéreuses sont capables d’extraire des nutriments essentiels des muscles (notamment la glutamine) et d’autres tissus pour assurer leur subsistance, ce qui compromet l’effet escompté des restrictions alimentaires.
Réutilisation de médicaments anticancéreux pour lutter contre le cancer
Le développement de nouveaux médicaments anticancéreux devient de plus en plus difficile et coûteux. Pour trouver un remède thérapeutique efficace contre le cancer, les médicaments déjà approuvés cliniquement ou testés expérimentalement pour des affections autres que le cancer, mais dont la cytotoxicité pour les cellules malignes est inconnue jusqu’à présent, s’avèrent très utiles.
Les chercheurs en cancérologie ont identifié certaines molécules médicamenteuses qui pourraient servir de candidats anticancéreux adéquats en complément des thérapies conventionnelles. Par conséquent, la réaffectation de médicaments ayant une efficacité anticancéreuse peut être considérée comme une stratégie importante pour la thérapie du cancer aujourd’hui.8
En raison du mécanisme de reprogrammation métabolique décrit ci-dessus, par lequel les thérapies anticancéreuses standard échouent généralement, il serait plus logique de se concentrer sur des médicaments candidats repurifiés qui combattent ce même mécanisme. Ainsi, bien qu’il existe de nombreux candidats médicaments prometteurs pour compléter les thérapies anticancéreuses existantes, il est tout à fait justifié de se concentrer sur les médicaments qui permettent de surmonter une caractéristique spécifique du cancer en particulier : la reprogrammation métabolique.
Médicaments qui aident à surmonter la reprogrammation métabolique dans le cancer : Fenbendazole, dichloroacétate de sodium (DCA) et 2-désoxy-d-glucose (2-DG)
a) Comment les trois médicaments ont des mécanismes uniques, indépendants et synergiques pour combattre la consommation excessive de glucose dans les cellules cancéreuses:
i. Fenbendazole – réduit les transporteurs GLUT et affecte l’hexokinase 2
Le fenbendazole (FBZ) (N-(6-phénylsulfanyl-1H-benzimidazol-2-yl) carbamate de méthyle) est une classe de médicaments à base de benzimidazole, qui est utilisée comme médicament anticancéreux. Le FBZ a un effet anticancéreux prouvé car il arrête la prolifération cellulaire, réduit l’absorption du glucose et déclenche la mort cellulaire par apoptose.9 ,10,11
La réaffectation du fenbendazole est donc une option importante dans le traitement du cancer, qui peut réduire le temps et les coûts considérables nécessaires au développement de nouveaux médicaments.
Le cancer est associé à un trouble métabolique dans lequel les cellules cancéreuses préfèrent sélectivement la glycolyse aérobie inefficace (qui ne génère que 2 molécules d’ATP) à la phosphorylation oxydative mitochondriale (qui génère 38 molécules d’ATP) pour répondre à leurs besoins énergétiques. La glycolyse aérobie étant un processus inefficace sur le plan énergétique, les cellules cancéreuses doivent multiplier par plusieurs fois leur consommation de glucose.
Les cellules cancéreuses augmentent l’absorption du glucose en régulant le GLUT1, une protéine membranaire qui facilite l’absorption basale du glucose. Le traitement par FBZ entraîne une réduction de l’absorption du glucose dans les cellules cancéreuses en raison de la régulation des transporteurs GLUT et d’autres enzymes glycolytiques clés comme l’hexokinase II (HKII), la protéine de la membrane qui facilite l’absorption basale du glucose.
Afin de stimuler la glycolyse aérobie, de nombreuses enzymes glycolytiques sont régulées à la hausse au cours de la tumorigénèse. L’hexokinase II (HKII), une enzyme glycolytique clé, joue un rôle essentiel dans la rétention et le métabolisme du glucose en phosphorylant le glucose en glucose-6-phosphate, qui peut ensuite entrer dans la glycolyse.
L’HKII est donc une enzyme très avantageuse pour la survie et la prolifération des cellules cancéreuses. Le FBZ altère la fonction enzymatique de l’HKII dans les cellules cancéreuses, ce qui entraîne une réduction de la rétention du glucose dans les cellules traitées par le FBZ. Les cellules cancéreuses finissent par mourir parce qu’elles ne peuvent pas utiliser le glucose comme source d’énergie par le biais de la glycolyse aérobie.11
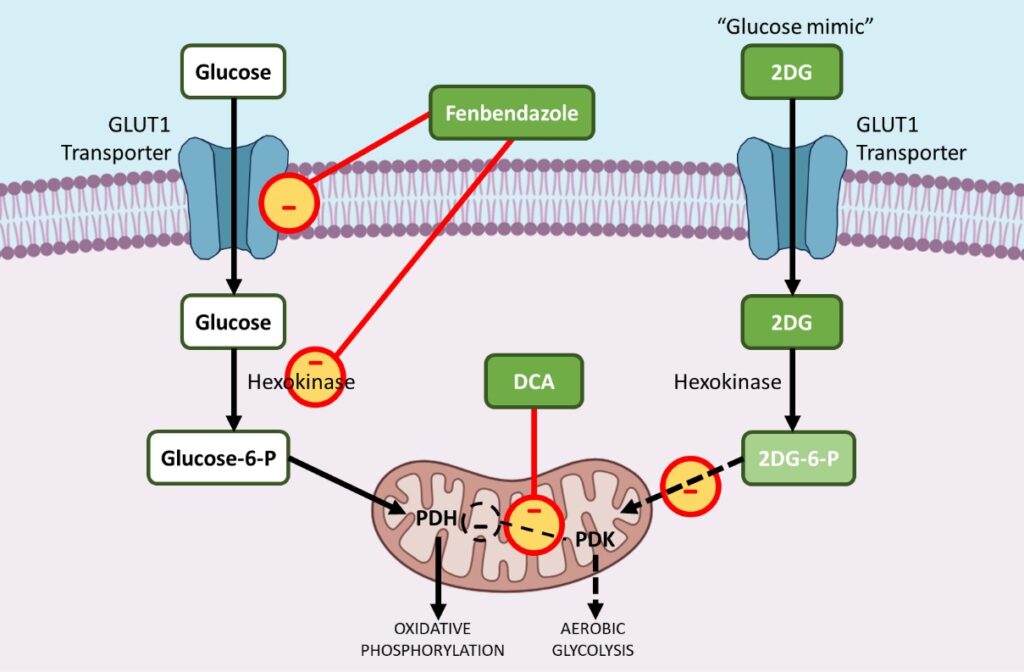
Surmonter la programmation métabolique du cancer grâce au fenbendazole, au DCA et au 2-DG
ii. DCA – inhabités pyruvate dehydrogenase kinase (PDK)
Le dichloroacétate de sodium (DCA), une petite molécule déjà utilisée pour traiter l’acidose lactique aiguë et chronique, a été largement réaffecté comme médicament anticancéreux.12,13
Les cellules cancéreuses tirent leur énergie d’une glycolyse excessive plutôt que de la phosphorylation oxydative mitochondriale. En régulant la glycolyse aérobie et en augmentant l’acidité du microenvironnement tumoral, les cellules cancéreuses bénéficient d’un avantage certain. L’acidose métabolique dans le microenvironnement tumoral inhibe l’apoptose ou les mécanismes naturels de mort cellulaire et contribue à renforcer la résistance aux médicaments.
Au cours de la cancérogenèse, la plupart des enzymes glycolytiques sont régulées à la hausse, tandis que les enzymes qui contribuent à la phosphorylation oxydative dans les mitochondries sont préférentiellement régulées à la baisse. La pyruvate déshydrogénase kinase (PDK) est une enzyme de contrôle qui régule le flux de glucose dans les mitochondries, siège de la phosphorylation oxydative. En présence d’une PDK activée, la pyruvate déshydrogénase (PDH), une enzyme de phosphorylation pro-oxydante, est inhibée, ce qui limite l’entrée du pyruvate dans les mitochondries, où l’oxydation du glucose peut avoir lieu.
Cela déplace le métabolisme vers la glycolyse. Le DCA cible sélectivement les cellules cancéreuses en faisant passer leur métabolisme de la glycolyse à la phosphorylation oxydative par l’inhibition de la pyruvate déshydrogénase kinase (PDK), l’inhibiteur de la pyruvate déshydrogénase (PDH).
L’activation des enzymes PDH favorise la phosphorylation oxydative au lieu de la glycolyse aérobie, la voie préférée par laquelle les cellules cancéreuses répondent à cette forte demande d’énergie, perturbant ainsi l’avantage métabolique des cellules cancéreuses et les rendant plus sensibles aux médicaments chimiothérapeutiques.
iii. 2-DG – un analogue ou « mimique » du glucose qui bloque des enzymes clés comme l’hexokinase et la glucose-6-phosphate isomérase
Le 2-deoxy-D-glucose (2-DG) est un analogue naturel du glucose, non métabolisable, dont le groupe 2-hydroxyle a été remplacé par de l’hydrogène. Le 2DG inhibe de manière compétitive la captation du glucose car le glucose et le 2-DG sont tous deux transportés à l’intérieur de la cellule par l’enzyme de transport du glucose (GLUT1). 14,15,16
Lorsque moins de glucose est transporté à l’intérieur de la cellule cancéreuse, moins de glycolyse aérobie peut se produire. La réduction de la glycolyse finit par arrêter la prolifération active des cellules cancéreuses.
Deuxièmement, après avoir pénétré dans la cellule, l’hexokinase phosphoryle le glucose et le 2DG pour former respectivement du glucose-6-phosphate et du 2-Désoxy-D-glucose-6-phosphate (2DG-6-P).
Le 2DG-6-P ne peut pas être métabolisé par la glycolyse. Il agit donc en inhibant de manière compétitive la production de glucose-6-phosphate à partir du glucose au cours de la glycolyse et inhibe ainsi le métabolisme du glucose dans les cellules cancéreuses.
b) Comment les trois médicaments ont des mécanismes uniques, indépendants et synergiques pour induire une apoptose sélective dans les cellules cancéreuses mais pas dans les cellules normales
i. Fenbendazole – interagit avec la β-tubuline pour empêcher la polymérisation et la formation de microtubules, ce qui entraîne l’arrêt du cycle cellulaire et la mort cellulaire apoptotique
Au cours de la division cellulaire, les microtubules, constitués de sous-unités de tubuline, forment des fuseaux pour permettre une ségrégation chromosomique correcte. Le FBZ perturbe la polymérisation de la tubuline, une étape essentielle de la prolifération cellulaire, assurant l’arrêt du cycle cellulaire dans les cellules cancéreuses en division active.
Qu’il s’agisse d’inhiber l’absorption accrue de glucose ou de cibler les microtubules pour arrêter la division cellulaire incontrôlée, le FBZ déclenche l’apoptose des cellules cancéreuses comme résultat final commun.
ii. DCA – augmente les espèces réactives de l’oxygène (ROS) dans les cellules cancéreuses, le stress oxydatif, l’activation des caspases et l’apoptose
Le dichloroacétate (DCA) est un inhibiteur de la pyruvate déshydrogénase kinase (PDK) qui phosphoryle la PDH en phospho PDH, le substrat actif de la glycolyse aérobie.13
L’inhibition de la PDK et l’activation de la PDH seraient associées à une production accrue d’espèces réactives de l’oxygène (ROS). Les ROS induisent des cassures double-brin dans l’ADN des cellules cancéreuses et augmentent leur sensibilité à la radiothérapie et à l’apoptose.
iii. 2-DG – prive les cellules cancéreuses de nutriments, provoque un stress oxydatif et la mort cellulaire par apoptose
Comme le 2DG imite les conditions de privation de glucose, il inhibe la glycolyse aérobie, ce qui conduit finalement à la privation de nutriments et à la mort cellulaire.
En outre, le gène GFAT1 joue un rôle important dans la glycosylation des protéines et est essentiel pour le métabolisme des cellules cancéreuses. L’administration de 2DG diminue le GFAT1 de manière dose-dépendante, ce qui entraîne une perturbation de la N-glycosylation des protéines. Cela provoque la mort cellulaire des cellules cancéreuses induite par le stress ER.
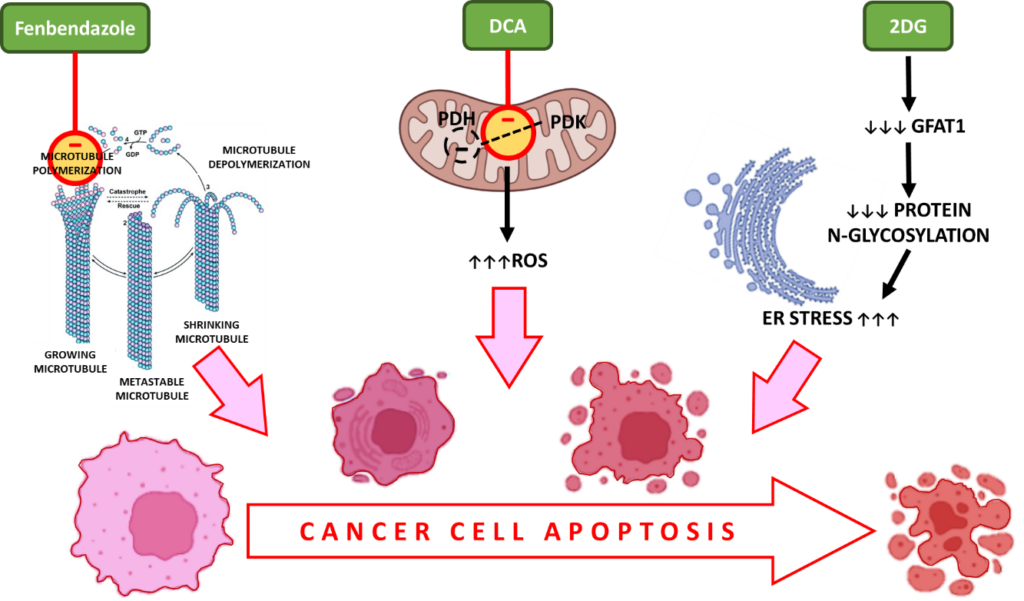
Induction De L’apoptose Dans Le Cancer Avec Le Fenbendazole, Le DCA Et Le 2-DG
c) Comment les trois médicaments complètent les traitements anticancéreux standard afin d’exercer des effets synergiques supplémentaires
i. Fenbendazole – faible profil d’effets secondaires, donc facile à administrer en même temps que les traitements traditionnels et à obtenir des effets synergiques
Un autre aspect important du FBZ est sa marge de sécurité élevée, sa faible toxicité et sa résistance minimale aux médicaments par rapport à d’autres agents chimiothérapeutiques tels que les taxanes et les alcaloïdes de la pervenche qui perturbent également la polymérisation de la tubuline et arrêtent la division cellulaire mais provoquent une toxicité aiguë chez l’homme.
En outre, le FBZ démontre également une réduction de la formation de nouveaux vaisseaux sanguins par angiogenèse et une inhibition de la croissance tumorale dans les cellules cancéreuses du poumon.
ii. DCA – Inverse la résistance à la chimiothérapie et à la radiothérapie
Le traitement au DCA inhibe la pyruvate déshydrogénase kinase (PDK). La diminution de la phosphorylation de la PDH par la PDK réduit la pyruvate déshydrogénase phosphorylée (pPDH), diminue la glycolyse aérobie, la production de lactate et le taux d’acidification extracellulaire (ECAR).
En perturbant la glycolyse aérobie, le DCA rend les cellules cancéreuses plus sensibles aux médicaments chimiothérapeutiques, tandis que l’augmentation des ROS rend les cellules cancéreuses plus sensibles aux radiations. Une étude réalisée sur des cellules cancéreuses du poumon et du foie a montré que l’administration conjointe de DCA et de paclitaxel, un agent chimiothérapeutique, augmentait la mort cellulaire apoptotique dans les cellules cancéreuses.
iii. 2-DG – ralentit les cellules cancéreuses métaboliquement trop actives et les rend plus vulnérables aux traitements traditionnels
Le 2DG est également connu pour induire l’expression de la protéine d’interaction avec la thiorédoxine (TXNIP), qui est une protéine suppresseur de tumeur. Ce faisant, il augmente la chimiosensibilité et la sensibilité aux radiations des cellules cancéreuses.
Il en résulte une augmentation de la mort cellulaire apoptotique en réponse à ces traitements conventionnels. Ainsi, le 2-DG agit comme un sensibilisateur à la chimiothérapie et à la radiothérapie dans les cellules cancéreuses.
Combattre le cancer avec le fenbendazole, le DCA et le 2-DG pour vaincre la reprogrammation métabolique
Le paradigme actuel du traitement du cancer repose en grande partie sur la chirurgie, la radiothérapie et la chimiothérapie. Cette approche combinée traditionnellement employée a permis de contrecarrer la progression du cancer dans de nombreux cas et même, dans certains cas, de guérir efficacement des patients.
Cependant, pour les patients diagnostiqués à un stade avancé et/ou métastatique de la maladie, ou ceux qui évoluent malheureusement vers un stade avancé et/ou métastatique de la maladie, l’approche combinée susmentionnée s’est avérée largement inefficace. La raison en est que les cellules cancéreuses, lorsqu’elles sont confrontées à une mort imminente due à la pression thérapeutique, peuvent souvent s’adapter grâce à un processus appelé reprogrammation métabolique, dans lequel elles apprennent à utiliser différemment les sources typiques d’énergie cellulaire, comme le glucose, d’une manière qui les rend résistantes à la chimiothérapie.
Et tant que cette adaptation métabolique ne sera pas ciblée, les traitements resteront largement inefficaces pour les cancers avancés et/ou métastatiques. Heureusement, il existe déjà des médicaments sûrs et efficaces pour surmonter la reprogrammation métabolique et ils sont actuellement disponibles pour les patients atteints de cancer. Trois de ces médicaments sont le fenbendazole, le DCA et le 2-DG, qui agissent chacun par le biais d’une variété de mécanismes.
Lorsqu’ils sont utilisés en combinaison, ils exercent souvent des effets synergiques et peuvent être encore plus efficaces que lorsqu’ils sont utilisés seuls. En outre, leur utilisation n’exclut pas le recours à des traitements standard tels que la chimiothérapie ou la radiothérapie.
D’après les données disponibles, l’administration de fenbendazole, de DCA et/ou de 2-DG en conjonction avec les traitements traditionnels devrait améliorer l’efficacité globale du traitement du cancer, en particulier dans les cas avancés et/ou métastatiques.
Perspectives d’avenir
Bien que des études et des essais cliniques soient en cours pour mieux comprendre comment ces trois médicaments peuvent être utilisés pour obtenir des avantages thérapeutiques, ils sont actuellement disponibles pour les patients et peuvent être combinés dans des schémas thérapeutiques
Références:
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
- Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer. Nature. 2019 Nov;575(7782):299-309. doi: 10.1038/s41586-019-1730-1. Epub 2019 Nov 13. PMID: 31723286; PMCID: PMC8008476.
- Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020 May 2;21(9):3233. doi: 10.3390/ijms21093233. PMID: 32370233; PMCID: PMC7247559.
- Nong S, Han X, Xiang Y, Qian Y, Wei Y, Zhang T, Tian K, Shen K, Yang J, Ma X. Metabolic reprogramming in cancer: Mechanisms and therapeutics. MedComm (2020). 2023 Mar 27;4(2):e218. doi: 10.1002/mco2.218. PMID: 36994237; PMCID: PMC10041388.
- Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
- Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
- Fu L, Jin W, Zhang J, Zhu L, Lu J, Zhen Y, Zhang L, Ouyang L, Liu B, Yu H. Repurposing non-oncology small-molecule drugs to improve cancer therapy: Current situation and future directions. Acta Pharm Sin B. 2022 Feb;12(2):532-557. doi: 10.1016/j.apsb.2021.09.006. Epub 2021 Sep 10. PMID: 35256933; PMCID: PMC8897051.
- Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep. 2018 Aug 9;8(1):11926. doi: 10.1038/s41598-018-30158-6. PMID: 30093705; PMCID: PMC6085345.
- Park D, Lee JH, Yoon SP. Anti-cancer effects of fenbendazole on 5-fluorouracil-resistant colorectal cancer cells. Korean J Physiol Pharmacol. 2022 Sep 1;26(5):377-387. doi: 10.4196/kjpp.2022.26.5.377. PMID: 36039738; PMCID: PMC9437363.
- Song B, Park EY, Kim KJ, Ki SH. Repurposing of Benzimidazole Anthelmintic Drugs as Cancer Therapeutics. Cancers (Basel). 2022 Sep 22;14(19):4601. doi: 10.3390/cancers14194601. PMID: 36230527; PMCID: PMC9559625.
- Tataranni T, Piccoli C. Dichloroacetate (DCA) and Cancer: An Overview towards Clinical Applications. Oxid Med Cell Longev. 2019 Nov 14;2019:8201079. doi: 10.1155/2019/8201079. PMID: 31827705; PMCID: PMC6885244.
- Parczyk J, Ruhnau J, Pelz C, Schilling M, Wu H, Piaskowski NN, Eickholt B, Kühn H, Danker K, Klein A. Dichloroacetate and PX-478 exhibit strong synergistic effects in a various number of cancer cell lines. BMC Cancer. 2021 Apr 30;21(1):481. doi: 10.1186/s12885-021-08186-9. PMID: 33931028; PMCID: PMC8086110.
- O’Neill S, Porter RK, McNamee N, Martinez VG, O’Driscoll L. 2-Deoxy-D-Glucose inhibits aggressive triple-negative breast cancer cells by targeting glycolysis and the cancer stem cell phenotype. Sci Rep. 2019 Mar 7;9(1):3788. doi: 10.1038/s41598-019-39789-9. PMID: 30846710; PMCID: PMC6405919.
- Pajak B, Siwiak E, Sołtyka M, Priebe A, Zieliński R, Fokt I, Ziemniak M, Jaśkiewicz A, Borowski R, Domoradzki T, Priebe W. 2-Deoxy-d-Glucose and Its Analogs: From Diagnostic to Therapeutic Agents. Int J Mol Sci. 2019 Dec 29;21(1):234. doi: 10.3390/ijms21010234. PMID: 31905745; PMCID: PMC6982256.
- Zhang D, Li J, Wang F, Hu J, Wang S, Sun Y. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014 Dec 28;355(2):176-83. doi: 10.1016/j.canlet.2014.09.003. Epub 2014 Sep 10. PMID: 25218591.