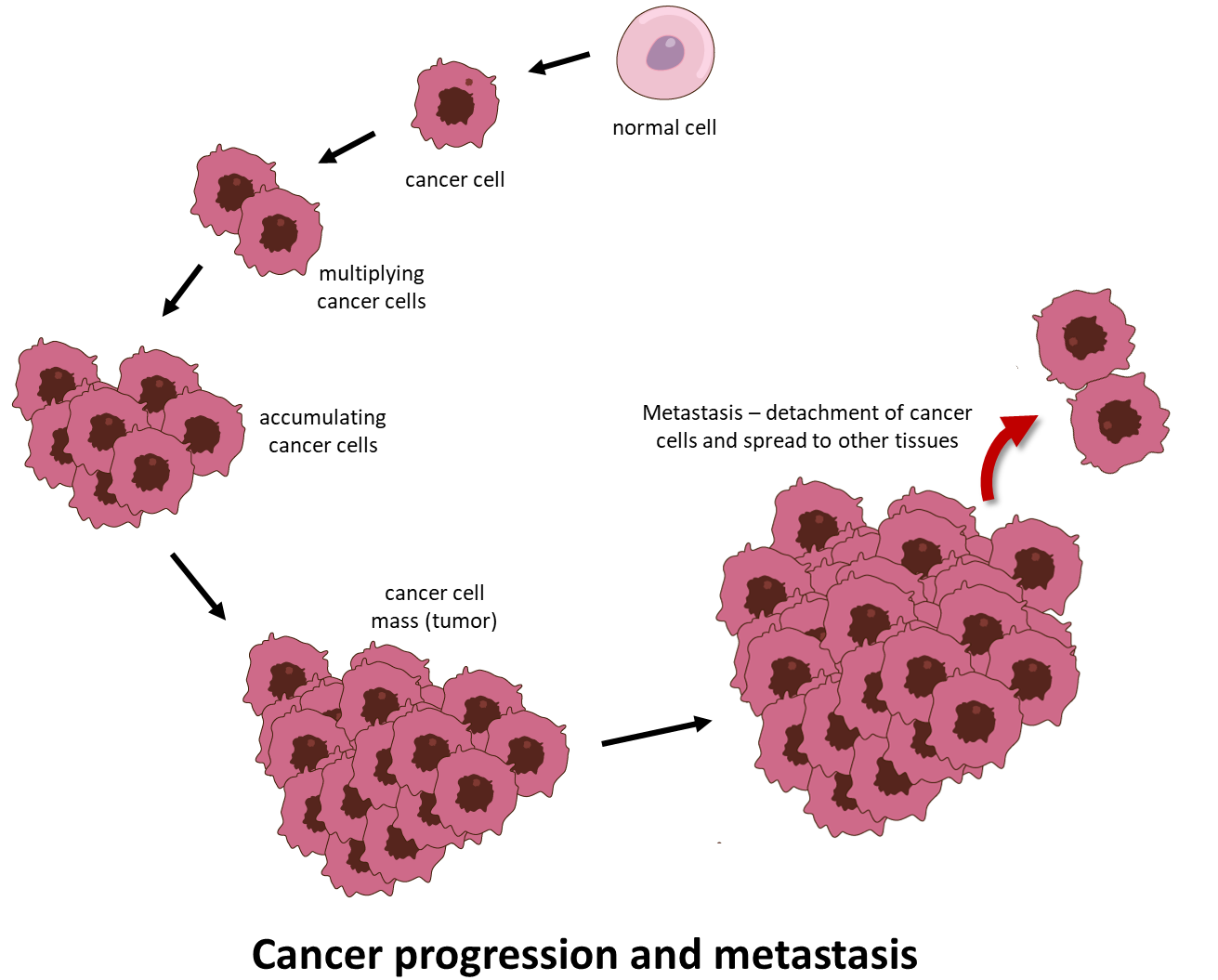
Krebs ist eine beängstigende Krankheit, bei der sich abnormale Zellen unkontrolliert teilen und die Fähigkeit erlangen, sich über ihren Ursprungsort hinaus auszubreiten und entfernte Körpergewebe und Organe zu infiltrieren und zu zerstören. Dieser Prozess wird als Metastasierung bezeichnet und ist die häufigste Ursache für krebsbedingte Todesfälle (Figure 1).
Im Jahr 2020 wurden weltweit 19,3 Millionen neue Krebsfälle gemeldet, von denen schätzungsweise 10,0 Millionen tödlich verlaufen werden.1 Die Zahl der Krebserkrankungen nimmt weiter zu und damit auch die Zahl der krebsbedingten Todesfälle. Die rasanten Fortschritte in der Krebsforschung der letzten fünf Jahrzehnte haben gezeigt, dass Krebszellen während der Tumorentstehung zellphysiologische Veränderungen erlangen, die sie von normalen Zellen unterscheiden. Diese erworbenen Fähigkeiten, die auch als Kennzeichen von Krebs bezeichnet werden (Abbildung 2) sind allen Krebsarten gemeinsam.2 Zu diesen gemeinsamen Merkmalen gehören:
- Selbstgenügsamkeit bei Wachstumssignalen. Im Gegensatz zu normalen Zellen sind Krebszellen für ihre aktive Proliferation nicht von exogenen Wachstumsfaktoren abhängig. Stattdessen erlangen sie die Fähigkeit, Wachstumsfaktoren zu synthetisieren, auf die sie ansprechen, wodurch eine Signalschleife mit positiver Rückkopplung entsteht.
- Umgehung von Wachstumshemmern. Im Gegensatz zu normalen Zellen, in denen mehrere lösliche Wachstumshemmer gegen die Proliferation wirken, um die zelluläre Ruhe und die Gewebehomöostase aufrechtzuerhalten, lernen Krebszellen irgendwie, antiproliferative Signale zu umgehen, die das Zellwachstum bremsen. Krebszellen proliferieren daher auch in Gegenwart von Wachstumshemmern weiter.
- Resistenz gegen den Zelltod. Krebszellen widersetzen sich den natürlichen Zelltodwegen, die unnötige oder potenziell gefährliche Zellen eliminieren..
- Angiogenese. Krebszellen lassen über die Angiogenese schnell Blutgefäße wachsen, um sich mit dem Kreislaufsystem zu verbinden und Sauerstoff und Nährstoffe zu erhalten, um zu überleben und sich zu vermehren.
- Invasion und Metastasierung. Krebszellen wandern vom Primärherd an entfernte Orte, a) um sich der Immunüberwachung zu entziehen, b) um den Mangel an Sauerstoff und notwendigen Nährstoffen aufgrund der Größe des Tumors zu überwinden, c) um dem durch die Anhäufung von überschüssiger Milchsäure verursachten Zelltod zu entgehen.
- Umgehung des Immunsystems. Tumore können sich den Angriffen des Immunüberwachungssystems durch verschiedene Mechanismen entziehen, z. B. indem sie die Erkennung von Antigenen einschränken, d. h. das Immunsystem davon abhalten, abtrünnige Krebszellen zu erkennen, und auch die T-Zellen, die Soldaten des Immunsystems, die abtrünnige Krebszellen erkennen, erschöpfen.
- Tumorfördernde Entzündung. Bei einer normalen Entzündungsreaktion produzieren die Immunzellen Chemikalien, die einen Krankheitserreger abtöten. Diese Chemikalien, die als reaktive Sauerstoffspezies bekannt sind, können auch die DNA normaler Zellen schädigen, was wiederum das Risiko von Mutationen erhöht und in der Folge die Krebsentwicklung aufgrund chronischer Entzündungen fördert.
- Mutation(en) und genomische Instabilität. Dies ist auf die erhöhte Tendenz zur Genomveränderung während der Zellteilung zurückzuführen. Eine abweichende DNA-Replikation trägt zum Erwerb von Mutationen und einem instabilen Genom bei, was wiederum zur Entwicklung von Malignität führt.
- Epigenetische Umprogrammierung. Dabei handelt es sich um Veränderungen in der zugrunde liegenden Chromatinstruktur eines Gens. Solche Veränderungen können ein krebsverursachendes Onkogen einschalten oder ein Tumorsuppressorgen ausschalten und den Prozess der Tumorentstehung unterstützen
- Polymorphe Genome. Oder genetische Variationen in Genen, die die DNA-Mismatch-Reparatur, die Regulierung des Zellzyklus, den Stoffwechsel und die Immunität regulieren, erhöhen die Anfälligkeit für Krebs.
- Phänotypische Plastizität. Die Fähigkeit von Krebszellen, ihre Form, Größe, Morphologie usw. dynamisch zu verändern, trägt dazu bei, dass sie sich dem Immunsystem entziehen, gegen Medikamente resistent werden und die Invasion und Fernwanderung von Krebszellen fördern.
- Metabolische Reprogrammierung. Die Fähigkeit von Krebszellen, ihren Stoffwechsel zu verändern, um den erhöhten Energiebedarf von sich schnell vermehrenden Krebszellen zu decken und dadurch „unsterblich“ zu werden.
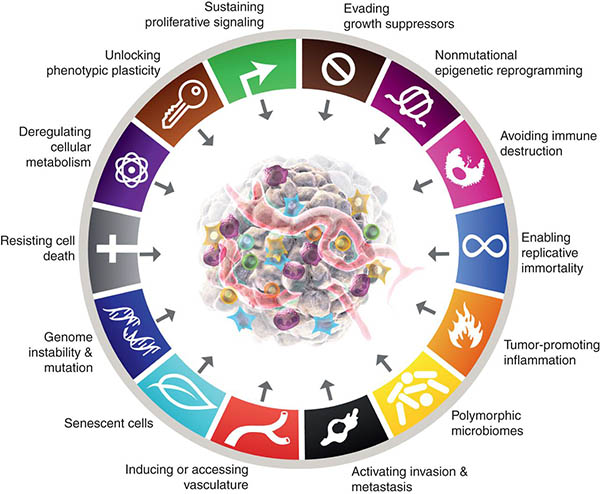
(Bild mit freundlicher Genehmigung von Cancer Discovery Journal https://www.aacr.org/blog/2022/01/21/new-dimensions-in-cancer-biology-updated-hallmarks-of-cancer-published/)
Aktuelle Herausforderungen Bei Der Suche Nach Der Richtigen Krebsbehandlung
Da es mehrere mögliche Faktoren gibt, die die Umwandlung normaler Zellen in bösartige Krebszellen vorantreiben, ist die Prävention nach wie vor sehr schwierig, und die Ausrottung von Krebs, wenn er sich bereits etabliert hat, stellt nach wie vor eine Vielzahl von Herausforderungen dar. Die herkömmliche Krebstherapie, einschließlich Chemo- und Strahlentherapie, zielt in erster Linie auf aktiv wuchernde Zellen ab.
Chemotherapeutische Arzneimittel unterscheiden nicht zwischen sich aktiv teilenden normalen Zellen und Krebszellen. Daher werden bei Patienten schwere toxische Wirkungen beobachtet, die auf den unbeabsichtigten, aber unvermeidlichen Verlust normaler Zellen zurückzuführen sind. Dies führt zu Neurotoxizität, Kardiotoxizität, gastrointestinaler Toxizität und Immunsuppression. Außerdem sind Chemotherapeutika häufig mit Resistenzen verbunden.3,4
Daher sind viele Krebspatienten, deren Krankheit nach einer kurzen Remission wieder auftritt, dringend auf alternative Arzneimittel angewiesen, die auch andere Krebsmerkmale behandeln und weniger toxisch sind.
Metabolische Umprogrammierung: Der Hauptgrund für das Scheitern bestehender Krebstherapien
Glukose ist die Hauptenergiequelle für normale, eukaryontische Zellen, die nicht an Krebs erkrankt sind. Während des Glukosestoffwechsels produzieren normale Zellen unter aeroben Bedingungen CO2 durch oxidative Phosphorylierung oder Laktat durch Glykolyse unter anaeroben Bedingungen. In Krebszellen spielt die Verschiebung des Stoffwechsels hin zu einem übermäßigen Glukoseverbrauch – über das 200-fache der normalen Rate, bekannt als aerobe Glykolyse oder Warburg-Effekt – eine entscheidende Rolle.5,6
Anders als in normalem Gewebe, wo Zellen nur unter sauerstoffarmen oder aneroben Bedingungen Glykolyse betreiben, programmieren Krebszellen den Stoffwechselweg so um, dass sie auch unter aeroben Bedingungen Glykolyse betreiben, um den hohen Energiebedarf der unkontrollierten Zellteilung zu decken; dies wird als Warburg-Effekt oder aerobe Glykolyse bezeichnet und ist ein entscheidendes Merkmal, das Krebszellen von normalen Zellen unterscheidet.
Diese Stoffwechselveränderung führt zu einer Überproduktion von Laktat, das dann aus den Zellen ausgeschieden wird. Diese Ausscheidung führt zu einer Anhäufung von Milchsäure, die die Übersäuerung der Mikroumgebung des Tumors fördert, ein Zustand, der das Immunsystem unterdrücken und möglicherweise die Wirksamkeit bestimmter Immuntherapien verringern kann.
Warum sind zuckerarme/ketogene Diäten unwirksam?
Außerdem sind Strategien wie ketogene Diäten oder der Verzicht auf Zucker in diesem Zusammenhang in der Regel unwirksam. Diese Ansätze beschleunigen oft die Kachexie, eine schwere Form des Muskel- und Gewichtsverlusts, und beschleunigen das Fortschreiten der Sterblichkeit.7
Diese Unwirksamkeit ist in erster Linie darauf zurückzuführen, dass Krebszellen sehr geschickt darin sind, essenzielle Nährstoffe aus Muskeln (insbesondere Glutamin) und anderen Geweben zu extrahieren, um sich zu ernähren, wodurch die beabsichtigte Wirkung von Diätbeschränkungen untergraben wird.
Wiederverwendung von Nicht-Krebs-Medikamenten zur Krebsbekämpfung
Die Entwicklung neuer Krebsmedikamente wird immer schwieriger und ist mit hohen Kosten verbunden. Um ein wirksames therapeutisches Heilmittel für Krebs zu finden, erweisen sich Medikamente, die bereits klinisch zugelassen oder experimentell für andere Krankheiten als Krebs getestet wurden, die aber eine bisher nicht erkannte Zytotoxizität gegenüber bösartigen Zellen aufweisen, als sehr nützlich.
Krebsforscher haben bestimmte Wirkstoffmoleküle identifiziert, die neben konventionellen Therapien als geeignete Kandidaten für die Krebsbekämpfung dienen könnten.Daher kann das Repurposing von Arzneimitteln mit Anti-Krebs-Wirkung heute als eine wichtige Strategie für die Krebstherapie angesehen werden.8
Aufgrund des oben beschriebenen Mechanismus der metabolischen Umprogrammierung, durch den Standardkrebstherapien in der Regel versagen, wäre es am sinnvollsten, sich auf neu entwickelte Arzneimittelkandidaten zu konzentrieren, die genau diesen Mechanismus bekämpfen. Es gibt zwar viele vielversprechende Arzneimittelkandidaten, die die bestehenden Krebstherapien ergänzen könnten, aber es gibt gute Gründe, sich auf diejenigen Medikamente zu konzentrieren, die ein bestimmtes Merkmal von Krebs besonders gut bekämpfen: die Umprogrammierung des Stoffwechsels.
Medikamente, die helfen, die metabolische Reprogrammierung bei Krebs zu überwinden: Fenbendazol, Natriumdichloracetat (DCA) und 2-Desoxy-d-glucose (2-DG)
a) Wie die 3 Medikamente einzigartige, unabhängige und synergistische Mechanismen zur Bekämpfung des übermäßigen Glukoseverbrauchs in Krebszellen haben:
i. Fenbendazol – reduziert GLUT-Transporter und beeinflusst Hexokinase 2
Fenbendazol (FBZ) (Methyl-N-(6-phenylsulfanyl-1H-benzimidazol-2-yl)-carbamat) ist eine Klasse von Benzimidazol-Medikamenten, die als Krebsmedikament eingesetzt werden. FBZ hat nachweislich eine krebshemmende Wirkung, da es die Zellproliferation stoppt, die Glukoseaufnahme verringert und den apoptotischen Zelltod auslöst.9 ,10,11
Das Repurposing von Fenbendazol ist daher eine wichtige Option in der Krebstherapie, die den erheblichen Zeit- und Kostenaufwand für die Entwicklung neuer Medikamente reduzieren kann.
Krebs ist mit einer Stoffwechselstörung verbunden, bei der die Krebszellen zur Deckung ihres Energiebedarfs selektiv die ineffiziente aerobe Glykolyse (die nur 2 Moleküle ATP erzeugt) der oxidativen Phosphorylierung in den Mitochondrien (die 38 Moleküle ATP erzeugt) vorziehen. Die aerobe Glykolyse ist ein energieineffizienter Prozess, so dass die Krebszellen ihren Glukoseverbrauch um ein Vielfaches steigern müssen.
Krebszellen erhöhen die Aufnahme von Glukose, indem sie GLUT1, ein Membranprotein, das die basale Aufnahme von Glukose erleichtert, hochregulieren. Die Behandlung mit FBZ führt zu einer verringerten Glukoseaufnahme in Krebszellen aufgrund der Herunterregulierung der GLUT-Transporter und anderer wichtiger glykolytischer Enzyme wie Hexokinase II (HKII).
Um die aerobe Glykolyse anzutreiben, werden viele glykolytische Enzyme während der Tumorentstehung hochreguliert. Hexokinase II (HKII), ein wichtiges glykolytisches Enzym, spielt eine entscheidende Rolle bei der Glukosespeicherung und dem Glukosestoffwechsel, indem es Glukose zu Glukose-6-Phosphat phosphoryliert, das dann in die Glykolyse eintreten kann.
HKII ist somit ein äußerst vorteilhaftes Enzym für das Überleben und die Vermehrung von Krebszellen. FBZ beeinträchtigt die enzymatische Funktion von HKII in Krebszellen, was zu einer verringerten Glukosespeicherung in FBZ-behandelten Zellen führt. Schließlich sterben die Krebszellen, weil sie Glukose nicht als Energiequelle über die aerobe Glykolyse nutzen können.11
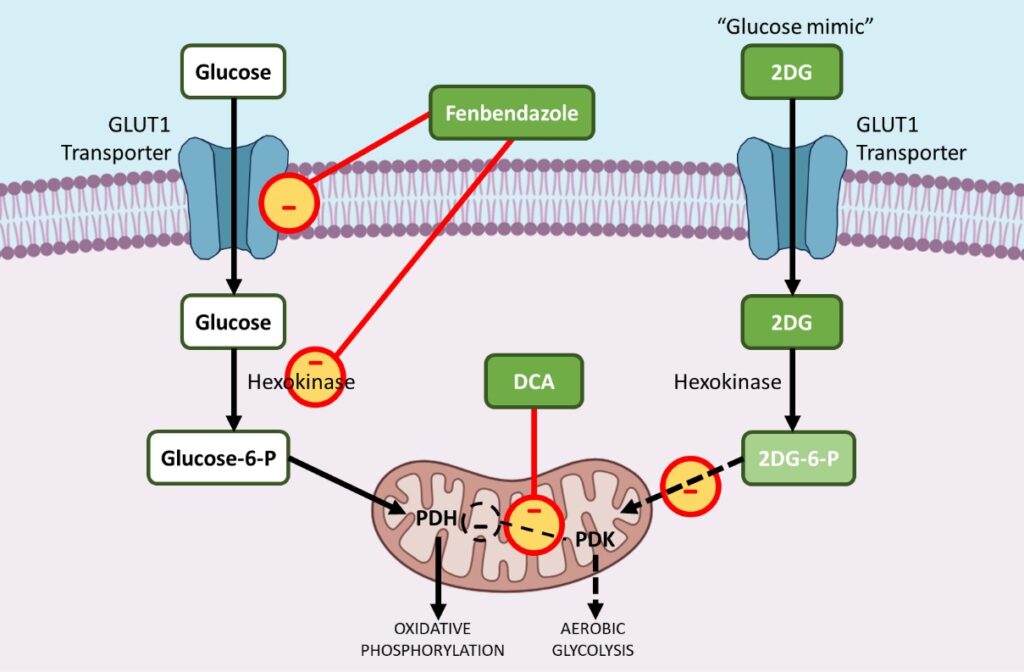
Überwindung der metabolischen Programmierung bei Krebs mit Fenbendazol, DCA und 2-DG
ii. DCA – hemmt die Pyruvat-Dehydrogenase-Kinase (PDK)
Natriumdichloracetat (DCA), ein kleines Molekül, das bereits zur Behandlung von akuter und chronischer Laktatazidose eingesetzt wird, wurde weitgehend als Krebsmedikament umgewidmet.12,13
Krebszellen beziehen ihre Energie aus einer übermäßigen Glykolyse anstelle der oxidativen Phosphorylierung in den Mitochondrien. Durch die Hochregulierung der aeroben Glykolyse und die Erhöhung des Säuregehalts der Mikroumgebung des Tumors haben die Krebszellen einen klaren Vorteil. Die metabolische Azidose in der Mikroumgebung des Tumors hemmt die Apoptose oder die natürlichen Zelltodmechanismen und trägt zur Resistenzbildung gegen Medikamente bei.
Während der Karzinogenese werden die meisten glykolytischen Enzyme hochreguliert, während Enzyme, die die oxidative Phosphorylierung in den Mitochondrien unterstützen, bevorzugt herunterreguliert werden. Die Pyruvat-Dehydrogenase-Kinase (PDK) ist ein Gatekeeping-Enzym, das den Glukosefluss in die Mitochondrien, den Sitz der oxidativen Phosphorylierung, reguliert. Bei aktivierter PDK wird die Pyruvatdehydrogenase (PDH), ein Enzym, das die oxidative Phosphorylierung fördert, gehemmt, wodurch der Eintritt von Pyruvat in die Mitochondrien, wo die Glukoseoxidation stattfinden kann, begrenzt wird.
Dadurch verschiebt sich der Stoffwechsel in Richtung Glykolyse. DCA zielt selektiv darauf ab, den Stoffwechsel der Krebszellen von der Glykolyse auf die oxidative Phosphorylierung umzustellen, indem es die Pyruvat-Dehydrogenase-Kinase (PDK), den Inhibitor der Pyruvat-Dehydrogenase (PDH), hemmt.
Die Aktivierung der PDH-Enzyme begünstigt die oxidative Phosphorylierung anstelle der aeroben Glykolyse, dem bevorzugten Weg, über den die Krebszellen ihren hohen Energiebedarf decken, wodurch der metabolische Vorteil der Krebszellen gestört wird und die Krebszellen empfindlicher auf Chemotherapeutika reagieren.
iii. 2-DG – Ein Glukoseanalogon Oder -Imitat“, Das Schlüsselenzyme Wie Hexokinase Und Glukose-6-Phosphat-Isomerase Blockiert
2-Desoxy-D-Glukose (2-DG) ist ein natürliches, nicht verstoffwechselbares Glukoseanalogon, bei dem die 2-Hydroxylgruppe durch Wasserstoff ersetzt ist. 2DG hemmt die Glukoseaufnahme konkurrierend, da sowohl Glukose als auch 2-DG durch das Glukose transportierende Enzym (GLUT1) in die Zelle transportiert werden. 14,15,16
Wenn weniger Glukose ins Innere der Krebszelle transportiert wird, kann auch weniger aerobe Glykolyse stattfinden. Die Verringerung der Glykolyse stoppt letztlich die aktive Zellproliferation der Krebszellen.
Zweitens phosphoryliert Hexokinase nach dem Eintritt in die Zelle sowohl Glukose als auch 2DG, um Glukose-6-Phosphat bzw. 2-Deoxy-D-Glukose-6-Phosphat (2DG-6-P) zu bilden.
2DG-6-P kann nicht weiter über die Glykolyse metabolisiert werden. Als solches hemmt es die Produktion von Glukose-6-Phosphat aus Glukose während der Glykolyse und hemmt so den Glukosestoffwechsel in Krebszellen.
b) How the 3 drugs have unique, independent and synergistic mechanisms to induce selective apoptosis in cancer cells but not in normal cells
i. Fenbendazol – interagiert mit β-Tubulin und verhindert die Polymerisation zu Mikrotubuli, was zum Stillstand des Zellzyklus und zum apoptotischen Zelltod führt
Während der Zellteilung bilden Mikrotubuli, die aus Tubulin-Untereinheiten bestehen, Spindeln, um eine korrekte Chromosomentrennung zu ermöglichen. FBZ unterbricht die Tubulinpolymerisation, einen wesentlichen Schritt während der Zellproliferation, und sorgt so für einen Stillstand des Zellzyklus in sich aktiv teilenden Krebszellen.
Ob durch die Hemmung der erhöhten Glukoseaufnahme oder durch die gezielte Beeinflussung der Mikrotubuli, um die unkontrollierte Zellteilung zu stoppen, löst FBZ als gemeinsames Endergebnis die Apoptose der Krebszellen aus.
ii. DCA – erhöht reaktive Sauerstoffspezies (ROS) in Krebszellen, oxidativen Stress, Caspase-Aktivierung und Apoptose
Dichloracetat (DCA) ist ein Inhibitor der Pyruvat-Dehydrogenase-Kinase (PDK), die PDH zu Phospho-PDH phosphoryliert, dem aktiven Substrat der aeroben Glykolyse.13
Es wird berichtet, dass die Hemmung der PDK und die Aktivierung der PDH mit einer erhöhten Produktion reaktiver Sauerstoffspezies (ROS) einhergehen. ROS führen zu Doppelstrangbrüchen in der DNA von Krebszellen und erhöhen deren Empfindlichkeit gegenüber Strahlentherapie und Apoptose.
iii. 2-DG – entzieht den Krebszellen die Nährstoffe, verursacht oxidativen Stress und apoptotischen Zelltod
Da 2DG die Bedingungen des Glukoseentzugs nachahmt, hemmt es die aerobe Glykolyse, was letztlich zu Nährstoffentzug und Zelltod führt.
Darüber hinaus ist GFAT1 ein Gen, das eine wichtige Rolle bei der Proteinglykosylierung spielt und für den Stoffwechsel von Krebszellen unerlässlich ist. Die Verabreichung von 2DG verringert GFAT1 in einer dosisabhängigen Weise, was zu einer Störung der N-Glykosylierung von Proteinen führt. Dies führt zum ER-Stress-induzierten Zelltod von Krebszellen.
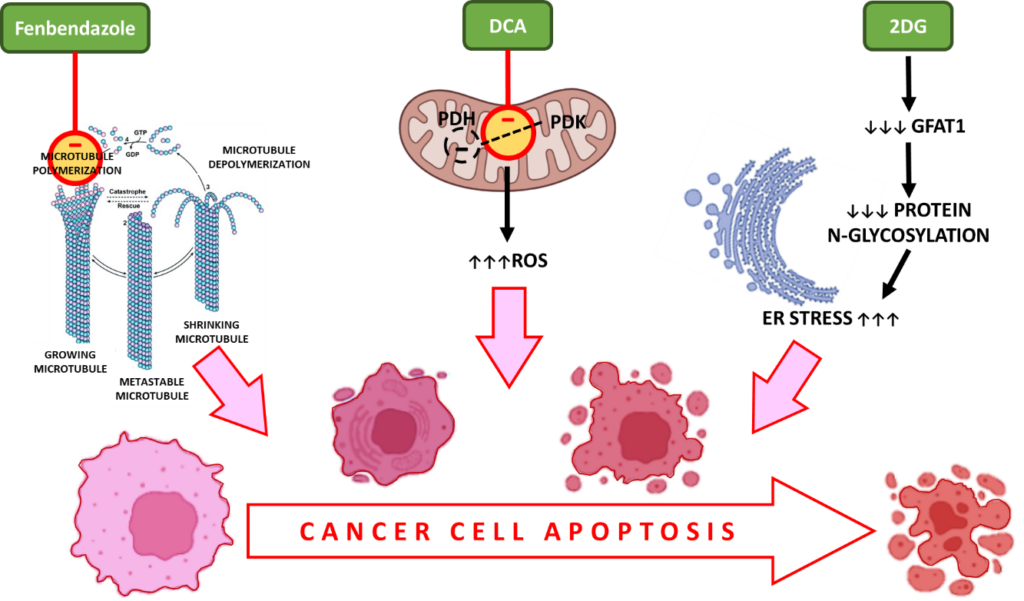
Auslösung der Apoptose bei Krebs mit Fenbendazol, DCA und 2-DG
c) Wie die 3 Medikamente Standard-Krebstherapien ergänzen, um weitere Synergieeffekte zu erzielen
i. Fenbendazol – geringes Nebenwirkungsprofil, daher leicht zusammen mit herkömmlichen Behandlungen zu verabreichen und Synergieeffekte zu erzielen
Ein weiterer wichtiger Aspekt von FBZ ist seine hohe Sicherheitsmarge, geringe Toxizität und minimale Arzneimittelresistenz im Vergleich zu anderen Chemotherapeutika wie Taxanen und Vinca-Alkaloiden, die ebenfalls die Tubulinpolymerisation unterbrechen und die Zellteilung stoppen, aber beim Menschen akute Toxizität verursachen.
Darüber hinaus zeigt FBZ auch eine Verringerung der Bildung neuer Blutgefäße durch Angiogenese und eine Hemmung des Tumorwachstums bei Lungenkrebszellen.
ii. DCA – hebt die Resistenz gegen Chemotherapie und Strahlentherapie auf
Die DCA-Behandlung hemmt die Pyruvat-Dehydrogenase-Kinase (PDK). Die Abnahme der PDH-Phosphorylierung durch PDK verringert die phosphorylierte Pyruvat-Dehydrogenase (pPDH), senkt die aerobe Glykolyse, die Laktatproduktion und die extrazelluläre Azidifikationsrate (ECAR).
Durch die Unterbrechung der aeroben Glykolyse macht DCA die Krebszellen empfindlicher für Chemotherapeutika, während eine erhöhte ROS die Strahlenempfindlichkeit der Krebszellen erhöht. Eine an Lungen- und Leberkrebszellen durchgeführte Studie zeigte, dass die gleichzeitige Verabreichung von DCA mit Paclitaxel, einem Chemotherapeutikum, den apoptotischen Zelltod in den Krebszellen erhöhte.
iii. 2-DG – verlangsamt metabolisch überaktive Krebszellen und macht sie anfälliger für herkömmliche Behandlungen
2DG ist auch dafür bekannt, die Expression des Thioredoxin-interagierenden Proteins (TXNIP), eines Tumorsuppressorproteins, zu induzieren. Auf diese Weise erhöht es die Chemosensitivität und Strahlenempfindlichkeit der Krebszellen.
Dies wiederum führt zu einem erhöhten apoptotischen Zelltod als Reaktion auf diese herkömmlichen Behandlungen. Somit wirkt 2-DG als Sensibilisator für Chemo- und Strahlentherapie in Krebszellen.
Krebsbekämpfung mit Fenbendazol, DCA und 2-DG zur Überwindung der metabolischen Umprogrammierung
Das derzeit vorherrschende Paradigma für die Krebsbehandlung beruht weitgehend auf Chirurgie, Strahlentherapie und Chemotherapie. Dieser traditionell angewandte Kombinationsansatz hat das Fortschreiten des Krebses in vielen Fällen erfolgreich aufgehalten und in einigen Fällen sogar zu einer effektiven Heilung der Patienten geführt.
Bei Patienten, bei denen entweder ein fortgeschrittenes und/oder metastasiertes Krankheitsstadium diagnostiziert wird oder die unglücklicherweise ein fortgeschrittenes und/oder metastasiertes Krankheitsstadium erreichen, war der oben genannte Kombinationsansatz jedoch weitgehend unwirksam. Der Grund dafür ist, dass sich Krebszellen, wenn sie aufgrund des therapeutischen Drucks mit dem bevorstehenden Tod konfrontiert sind, häufig durch einen Prozess namens „Metabolische Reprogrammierung“ anpassen können, bei dem sie lernen, typische zelluläre Energiequellen wie Glukose auf eine Weise zu nutzen, die sie resistent gegen die Chemotherapie macht.
Und solange diese Stoffwechselanpassung nicht gezielt angegangen wird, bleiben Behandlungen für fortgeschrittene und/oder metastasierende Krebserkrankungen weitgehend wirkungslos. Glücklicherweise gibt es bereits sichere und wirksame Medikamente zur Überwindung der metabolischen Reprogrammierung, die Krebspatienten derzeit zur Verfügung stehen. Zu diesen Medikamenten gehören Fenbendazol, DCA und 2-DG, die jeweils über verschiedene Mechanismen wirken.
Wenn sie in Kombination verwendet werden, entfalten sie oft synergistische Wirkungen und können sogar wirksamer sein als bei der alleinigen Verwendung. Außerdem schließt ihr Einsatz Standardbehandlungen wie Chemotherapie oder Strahlentherapie nicht aus
Auf der Grundlage der verfügbaren Daten ist davon auszugehen, dass die Verabreichung von Fenbendazol, DCA und/oder 2-DG in Verbindung mit herkömmlichen Behandlungen die Gesamtwirksamkeit der Krebsbehandlung verbessert, insbesondere bei fortgeschrittenen und/oder metastasierten Erkrankungen.
Zukünftiger Ausblick
Während klinische Studien und Versuche laufen, um besser zu verstehen, wie diese 3 Medikamente weiter für den therapeutischen Nutzen eingesetzt werden können, stehen sie heute für Patienten zur Verfügung, um in Behandlungsregimen kombiniert zu werden.
Referenzen:
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
- Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer. Nature. 2019 Nov;575(7782):299-309. doi: 10.1038/s41586-019-1730-1. Epub 2019 Nov 13. PMID: 31723286; PMCID: PMC8008476.
- Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020 May 2;21(9):3233. doi: 10.3390/ijms21093233. PMID: 32370233; PMCID: PMC7247559.
- Nong S, Han X, Xiang Y, Qian Y, Wei Y, Zhang T, Tian K, Shen K, Yang J, Ma X. Metabolic reprogramming in cancer: Mechanisms and therapeutics. MedComm (2020). 2023 Mar 27;4(2):e218. doi: 10.1002/mco2.218. PMID: 36994237; PMCID: PMC10041388.
- Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
- Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
- Fu L, Jin W, Zhang J, Zhu L, Lu J, Zhen Y, Zhang L, Ouyang L, Liu B, Yu H. Repurposing non-oncology small-molecule drugs to improve cancer therapy: Current situation and future directions. Acta Pharm Sin B. 2022 Feb;12(2):532-557. doi: 10.1016/j.apsb.2021.09.006. Epub 2021 Sep 10. PMID: 35256933; PMCID: PMC8897051.
- Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep. 2018 Aug 9;8(1):11926. doi: 10.1038/s41598-018-30158-6. PMID: 30093705; PMCID: PMC6085345.
- Park D, Lee JH, Yoon SP. Anti-cancer effects of fenbendazole on 5-fluorouracil-resistant colorectal cancer cells. Korean J Physiol Pharmacol. 2022 Sep 1;26(5):377-387. doi: 10.4196/kjpp.2022.26.5.377. PMID: 36039738; PMCID: PMC9437363.
- Song B, Park EY, Kim KJ, Ki SH. Repurposing of Benzimidazole Anthelmintic Drugs as Cancer Therapeutics. Cancers (Basel). 2022 Sep 22;14(19):4601. doi: 10.3390/cancers14194601. PMID: 36230527; PMCID: PMC9559625.
- Tataranni T, Piccoli C. Dichloroacetate (DCA) and Cancer: An Overview towards Clinical Applications. Oxid Med Cell Longev. 2019 Nov 14;2019:8201079. doi: 10.1155/2019/8201079. PMID: 31827705; PMCID: PMC6885244.
- Parczyk J, Ruhnau J, Pelz C, Schilling M, Wu H, Piaskowski NN, Eickholt B, Kühn H, Danker K, Klein A. Dichloroacetate and PX-478 exhibit strong synergistic effects in a various number of cancer cell lines. BMC Cancer. 2021 Apr 30;21(1):481. doi: 10.1186/s12885-021-08186-9. PMID: 33931028; PMCID: PMC8086110.
- O’Neill S, Porter RK, McNamee N, Martinez VG, O’Driscoll L. 2-Deoxy-D-Glucose inhibits aggressive triple-negative breast cancer cells by targeting glycolysis and the cancer stem cell phenotype. Sci Rep. 2019 Mar 7;9(1):3788. doi: 10.1038/s41598-019-39789-9. PMID: 30846710; PMCID: PMC6405919.
- Pajak B, Siwiak E, Sołtyka M, Priebe A, Zieliński R, Fokt I, Ziemniak M, Jaśkiewicz A, Borowski R, Domoradzki T, Priebe W. 2-Deoxy-d-Glucose and Its Analogs: From Diagnostic to Therapeutic Agents. Int J Mol Sci. 2019 Dec 29;21(1):234. doi: 10.3390/ijms21010234. PMID: 31905745; PMCID: PMC6982256.
- Zhang D, Li J, Wang F, Hu J, Wang S, Sun Y. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014 Dec 28;355(2):176-83. doi: 10.1016/j.canlet.2014.09.003. Epub 2014 Sep 10. PMID: 25218591.