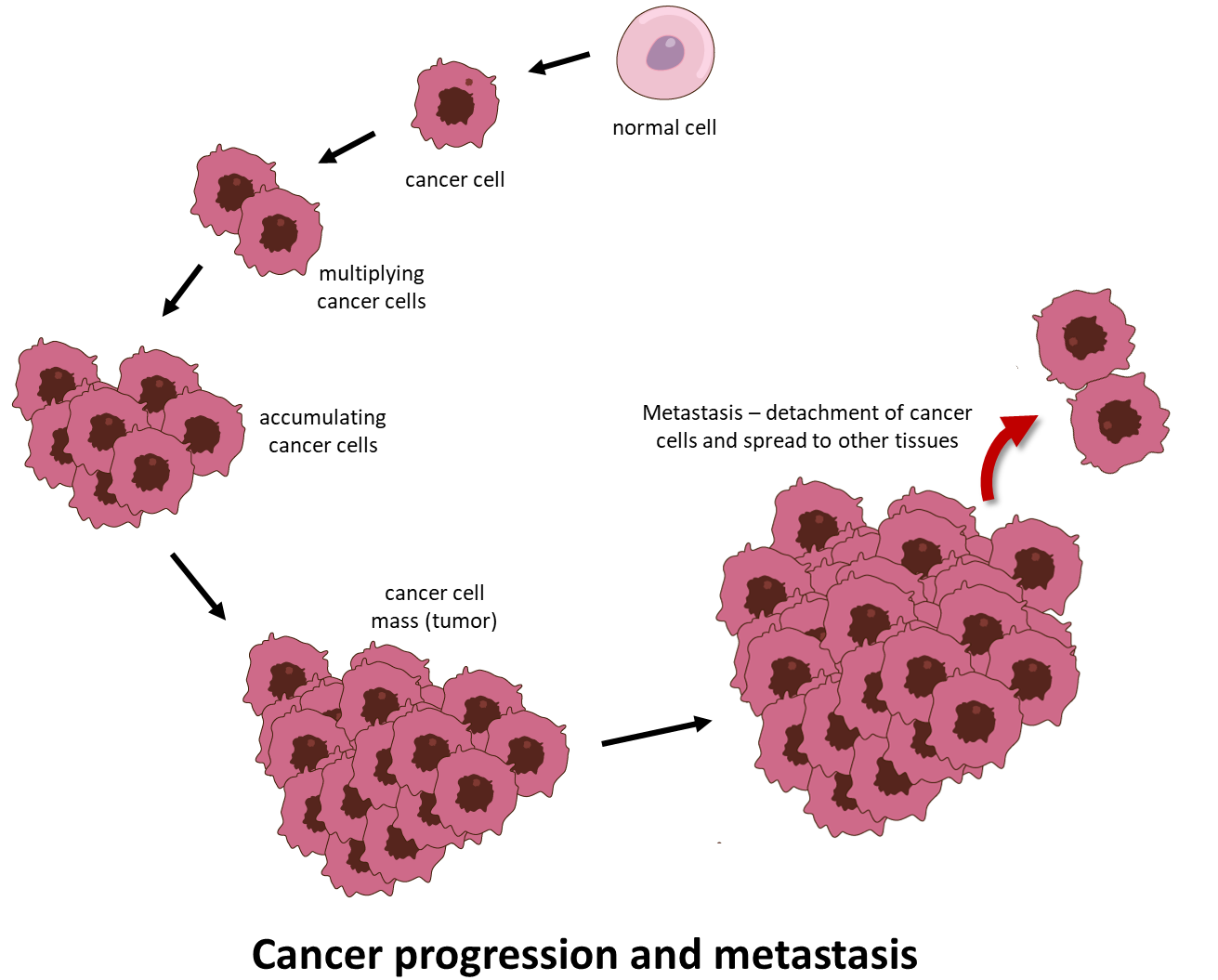
Cancer är en skrämmande sjukdom där onormala celler delar sig okontrollerat och får förmågan att sprida sig bortom sin ursprungsplats, infiltrera och förstöra avlägsna kroppsvävnader och organ. Denna senare process kallas metastasering och är den enskilt vanligaste orsaken till cancerrelaterade dödsfall (Figure 1).
År 2020 rapporterades 19,3 miljoner nya cancerfall i världen, varav 10,0 miljoner dödsfall.1 Antalet cancerfall fortsätter att öka, och det gör även antalet cancerrelaterade dödsfall. De senaste fem decenniernas snabba framsteg inom cancerforskningen har visat att cancerceller under tumörutvecklingen förvärvar förändringar i cellfysiologin som gör att de skiljer sig från normala celler. Dessa förvärvade förmågor, även kända som kännetecken för cancer (Figure 2) är gemensamma för alla typer av cancer.2 Dessa gemensamma drag inkluderar:
- Självförsörjning av tillväxtsignaler. Till skillnad från normala celler är cancerceller inte beroende av exogena tillväxtfaktorer för aktiv proliferation. Istället får de förmågan att syntetisera tillväxtfaktorer som de reagerar på, vilket skapar en positiv feedback-signaleringsslinga.
- Undvikande av tillväxthämmare. Till skillnad från normala celler, där flera antiproliferativa lösliga tillväxthämmare verkar för att upprätthålla cellens lugn och vävnadens homeostas, lär sig cancerceller på något sätt att kringgå antiproliferativa signaler som bromsar celltillväxten. Cancerceller fortsätter därför att föröka sig även i närvaro av tillväxthämmande ämnen.
- Motstånd mot celldöd. Cancerceller motsätter sig naturliga celldödsprocesser som eliminerar onödiga eller potentiellt farliga celler.
- Angiogenes. Cancerceller får snabbt blodkärl att växa via angiogenes för att ansluta till cirkulationssystemet och få tillgång till syre och näringsämnen för att överleva och föröka sig.
- Invasion och metastasering. Cancerceller förflyttar sig från den primära platsen till avlägsna platser a) för att undvika immunövervakning, b) för att övervinna brist på syre och nödvändiga näringsämnen på grund av tumörens storlek, c) för att undkomma celldöd orsakad av ackumulering av överskott av mjölksyra.
- Undvikande av immunförsvaret. Tumörer kan undvika attacker från immunförsvaret genom olika mekanismer, t.ex. genom att begränsa igenkänningen av antigener, dvs. de lurar immunförsvaret att inte känna igen oseriösa cancerceller och leder också till utmattning av T-celler, immunförsvarets soldater som känner igen oseriösa cancerceller.
- Tumörfrämjande inflammation. Vid en normal inflammatorisk reaktion producerar immunceller kemikalier som dödar en patogen. Dessa kemikalier, som kallas reaktiva syreföreningar, kan också skada DNA i normala celler, vilket i sin tur ökar risken för mutationer och därefter driver på cancerutvecklingen på grund av kronisk inflammation..
- Mutation(er) och genomisk instabilitet. Detta inträffar på grund av den ökade tendensen till genomförändring under celldelning. Avvikande DNA-replikation bidrar till förvärv av mutation(er) och ett instabilt genom, vilket i sin tur leder till utveckling av malignitet.
- Epigenetisk omprogrammering. Detta är förändringar i den underliggande kromatinstrukturen hos en gen. Sådana förändringar kan aktivera en cancerframkallande onkogen eller inaktivera en tumörsuppressorgen och bidra till tumörbildningsprocessen.
- Polymorfa genom. Eller genetiska variationer i gener som reglerar reparation av DNA-mismatchning, cellcykelreglering, metabolism och immunitet ökar känsligheten för cancer.
- Fenotypisk plasticitet. Cancercellernas förmåga att genomgå dynamiska förändringar i form, storlek, morfologi etc. bidrar till immunförsvarsundvikande och läkemedelsresistens samt främjar invasion och långväga migration av cancerceller.
- Metabolisk omprogrammering. Cancercellernas förmåga att ändra sin ämnesomsättning för att tillgodose det ökade energibehovet hos snabbt förökande cancerceller, och på så sätt bli ”odödliga”.
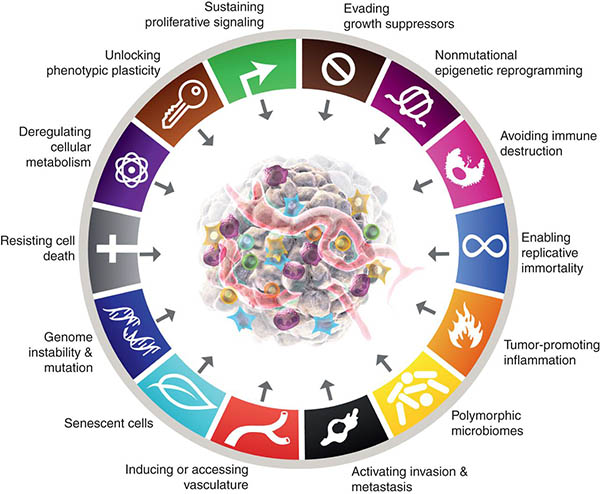
(Bild med tillstånd av Cancer Discovery Journal https://www.aacr.org/blog/2022/01/21/new-dimensions-in-cancer-biology-updated-hallmarks-of-cancer-published/)
Aktuella Utmaningar För Att Hitta Rätt Cancerbehandling
Eftersom det finns flera möjliga faktorer som driver omvandlingen av normala celler till maligna cancerceller, är det fortfarande mycket svårt att förebygga cancer och att utrota den när den redan har etablerat sig innebär fortfarande otaliga utmaningar. Konventionell cancerbehandling, inklusive kemoterapi och strålbehandling, riktar sig främst mot aktivt prolifererande celler.
Kemoterapeutiska läkemedel skiljer inte mellan aktivt delande normala celler och cancerceller. Därför observeras allvarliga toxiska effekter hos patienter på grund av oavsiktlig men oundviklig förlust av normala celler. Detta leder till neurotoxicitet, kardiotoxicitet, gastrointestinal toxicitet och immunsuppression. Dessutom är kemoterapeutiska läkemedel ofta förknippade med resistens.3,4
Många cancerpatienter vars sjukdom återkommer efter en kort remission är därför i stort behov av alternativa läkemedel som även behandlar andra kännetecken för cancer och orsakar mindre toxicitet.
Metabolisk omprogrammering: Den viktigaste orsaken till att existerande cancerterapier misslyckas
Glukos är den huvudsakliga energikällan för normala, eukaryota, icke-cancerceller. Under glukosmetabolismen producerar normala celler CO2 via oxidativ fosforylering under aeroba förhållanden eller laktat via glykolys under anaeroba förhållanden. I cancerceller spelar den metaboliska förskjutningen mot överdriven glukoskonsumtion – över 200 gånger den normala hastigheten, känd som aerob glykolys eller Warburg-effekten – en avgörande roll.5,6
Till skillnad från i normala vävnader, där celler endast uppvisar glykolys under syrebegränsade eller aneroba förhållanden, omprogrammerar cancerceller den metaboliska vägen för att utföra glykolys även under aeroba förhållanden för att möta det höga energibehovet vid okontrollerad celldelning; detta kallas Warburg-effekten eller aerob glykolys och är en kritisk egenskap som skiljer cancerceller från normala celler.
Denna metaboliska förändring leder till en överproduktion av laktat, som sedan drivs ut från cellerna. Utdrivningen leder till ackumulering av mjölksyra, vilket främjar försurning av tumörens mikromiljö, ett tillstånd som kan hämma immunförsvaret och potentiellt minska effekten av vissa immunterapibehandlingar.
Varför Är Sockerfattiga/Ketogena Dieter Ineffektiva?
Dessutom är strategier som ketogen kost eller undvikande av socker i allmänhet ineffektiva i detta sammanhang. Dessa strategier påskyndar ofta kakexi, en allvarlig form av muskel- och viktförlust, vilket påskyndar utvecklingen mot dödlighet.7
Denna ineffektivitet beror främst på att cancerceller är skickliga på att utvinna viktiga näringsämnen från muskler (särskilt glutamin) och andra vävnader för sin försörjning, vilket undergräver den avsedda effekten av kostrestriktioner.
Omställning Av Läkemedel Som Inte Är Cancerläkemedel För Att Bekämpa Cancer
Utvecklingen av nya läkemedel mot cancer blir allt svårare och mer kostsam. För att hitta ett effektivt terapeutiskt botemedel mot cancer visar sig läkemedel som redan är kliniskt godkända eller experimentellt testade för andra tillstånd än cancer, men som har visat sig ha en tidigare okänd cytotoxicitet mot maligna celler, vara mycket användbara.
Cancerforskare har identifierat vissa läkemedelsmolekyler som skulle kunna fungera som lämpliga kandidater för cancerbehandling vid sidan av konventionella terapier. Därför kan repurposing av läkemedel med anticancereffekt betraktas som en viktig strategi för cancerbehandling idag.8
På grund av den ovan beskrivna mekanismen för metabol omprogrammering genom vilken standardbehandlingar av cancer vanligtvis misslyckas, skulle det vara mest logiskt att fokusera på omarbetade läkemedelskandidater som bekämpar just denna mekanism. Även om det finns många lovande läkemedelskandidater som kan komplettera befintliga cancerbehandlingar, finns det starka skäl att fokusera på de läkemedel som övervinner ett specifikt kännetecken för just cancer: metabolisk omprogrammering.
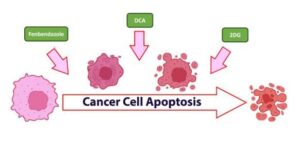
Läkemedel som hjälper till att övervinna metabolisk omprogrammering vid cancer: Fenbendazol, natriumdikloracetat (DCA) och 2-deoxi-d-glukos (2-DG)
a) Hur de 3 läkemedlen har unika, oberoende och synergistiska mekanismer för att bekämpa överdriven glukosförbrukning i cancerceller:
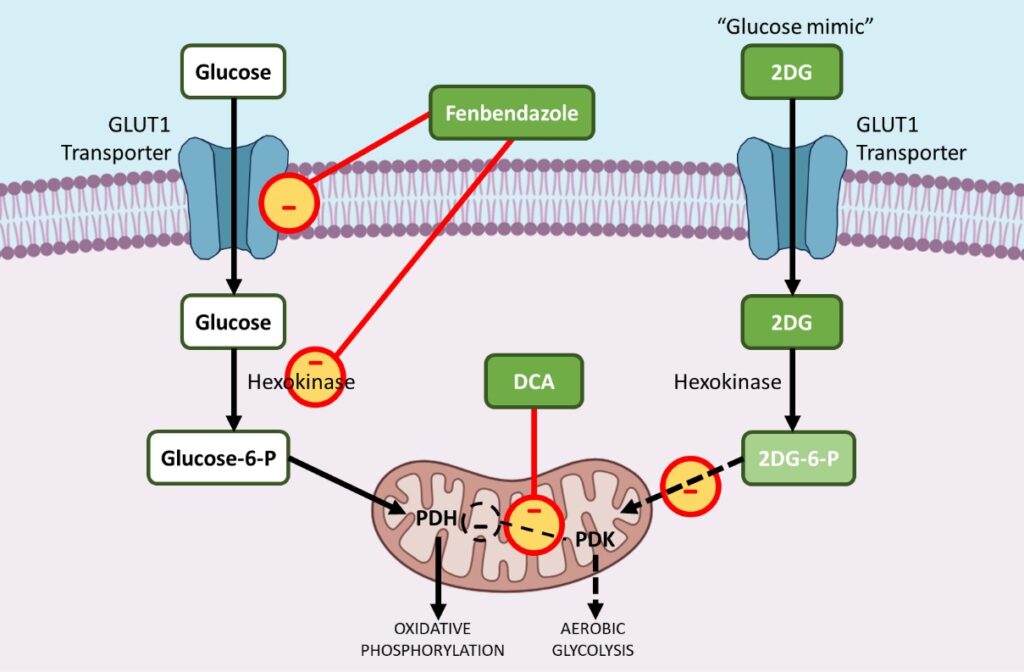
i. Fenbendazol – minskar GLUT-transportörer och påverkar hexokinas 2
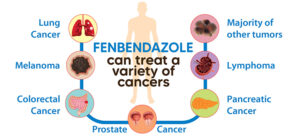
Fenbendazol (FBZ) (metyl-N-(6-fenylsulfanyl-1H-bensimidazol-2-yl)karbamat) är en klass av benzimidazole-läkemedel, som används som ett läkemedel mot cancer. FBZ har bevisad anticancereffekt eftersom det stoppar cellproliferation, sänker glukosupptaget och utlöser apoptotisk celldöd.9 ,10,11
Återanvändning av fenbendazol är därför ett viktigt alternativ vid cancerbehandling som kan minska den avsevärda tid och kostnad som krävs för att utveckla nya läkemedel.
Cancer förknippas med en metabolisk störning där cancercellerna selektivt föredrar ineffektiv aerob glykolys (som endast genererar 2 ATP-molekyler) framför mitokondriell oxidativ fosforylering (som genererar 38 ATP-molekyler) för att tillgodose sina energibehov. Aerob glykolys är en energiineffektiv process, så cancercellerna måste öka sin glukosförbrukning flera gånger om.
Cancerceller ökar upptaget av glukos genom att uppreglera GLUT1, ett membranprotein som underlättar det basala upptaget av glukos. Behandling med FBZ leder till minskat glukosupptag i cancerceller på grund av nedreglering av GLUT-transportörer och andra viktiga glykolytiska enzymer som hexokinas II (HKII).
För att driva den aeroba glykolysen uppregleras många glykolytiska enzymer under tumörutvecklingen. Hexokinas II (HKII), ett viktigt glykolytiskt enzym, spelar en avgörande roll för glukosretention och metabolism genom att fosforylera glukos till glukos-6-fosfat, som sedan kan ingå i glykolysen.
HKII är således ett mycket fördelaktigt enzym för cancercellernas överlevnad och spridning. FBZ försämrar den enzymatiska funktionen hos HKII i cancerceller, vilket leder till minskad glukosretention i FBZ-behandlade celler. Till slut dör cancercellerna eftersom de inte kan utnyttja glukos som energikälla via aerob glykolys.11
Fenbendazol, DCA Och 2-DG För Att Övervinna Metabolisk Programmering Vid Cancer
ii. DCA – hämmar pyruvatdehydrogenaskinas (PDK)
DCA – hämmar pyruvatdehydrogenas-kinas (Natriumdikloracetat (DCA), en liten molekyl som redan används för att behandla akut och kronisk mjölksyraacidos, har i stor utsträckning omarbetats till ett läkemedel mot cancer.12,13
Cancerceller får energi från överdriven glykolys istället för från mitokondriell oxidativ fosforylering. Genom att uppreglera den aeroba glykolysen och öka surhetsgraden i tumörens mikromiljö har cancercellerna en klar fördel. Metabolisk acidos i tumörens mikromiljö hämmar apoptos eller naturliga celldödsmekanismer och bidrar till att bygga upp resistens mot läkemedelDK).
Under carcinogenes uppregleras de flesta glykolytiska enzymer, medan enzymer som bidrar till oxidativ fosforylering i mitokondrierna företrädesvis nedregleras. Pyruvatdehydrogenaskinas (PDK) är ett gatekeeping-enzym som reglerar flödet av glukos in i mitokondrierna, där den oxidativa fosforyleringen sker. I närvaro av aktiverat PDK hämmas pyruvatdehydrogenas (PDH), ett prooxidativt fosforyleringsenzym, vilket begränsar pyruvatets inträde i mitokondrierna, där glukosoxidation kan äga rum.
Detta förskjuter metabolismen mot glykolys. DCA är selektivt inriktat på cancerceller som skiftar sin ämnesomsättning från glykolys till oxidativ fosforylering genom hämning av pyruvatdehydrogenaskinas (PDK), hämmaren av pyruvatdehydrogenas (PDH).
Aktiveringen av PDH-enzymer gynnar oxidativ fosforylering i stället för aerob glykolys, den väg som cancercellerna föredrar för att tillgodose det höga energibehovet, vilket stör cancercellernas metaboliska fördel och gör cancercellerna mer känsliga för kemoterapeutiska läkemedel.
iii. 2-DG – en glukosanalog eller ”mimik” som blockerar viktiga enzymer som hexokinas och glukos-6-fosfatisomeras
2-deoxy-D-glukos (2-DG) är en naturlig, icke metaboliserbar glukosanalog, där 2-hydroxylgruppen har ersatts med väte. 2DG hämmar glukosupptaget eftersom både glukos och 2-DG transporteras in i cellen av det glukostransporterande enzymet (GLUT1). 14,15,16
När mindre glukos transporteras in i cancercellen kan mindre aerob glykolys ske. Minskningen av glykolysen stoppar i slutändan cancercellernas aktiva cellproliferation.
För det andra fosforylerar hexokinas både glukos och 2DG till glukos-6-fosfat respektive 2-Deoxy-D-glukos-6-fosfat (2DG-6-P) efter att ha trängt in i cellen.
2DG-6-P kan inte metaboliseras ytterligare via glykolysen. Därför verkar det genom att hämma produktionen av glukos-6-fosfat från glukos under glykolysen och på så sätt hämma glukosmetabolismen i cancerceller.
b) Hur de 3 läkemedlen har unika, oberoende och synergistiska mekanismer för att inducera selektiv apoptos i cancerceller men inte i normala celler
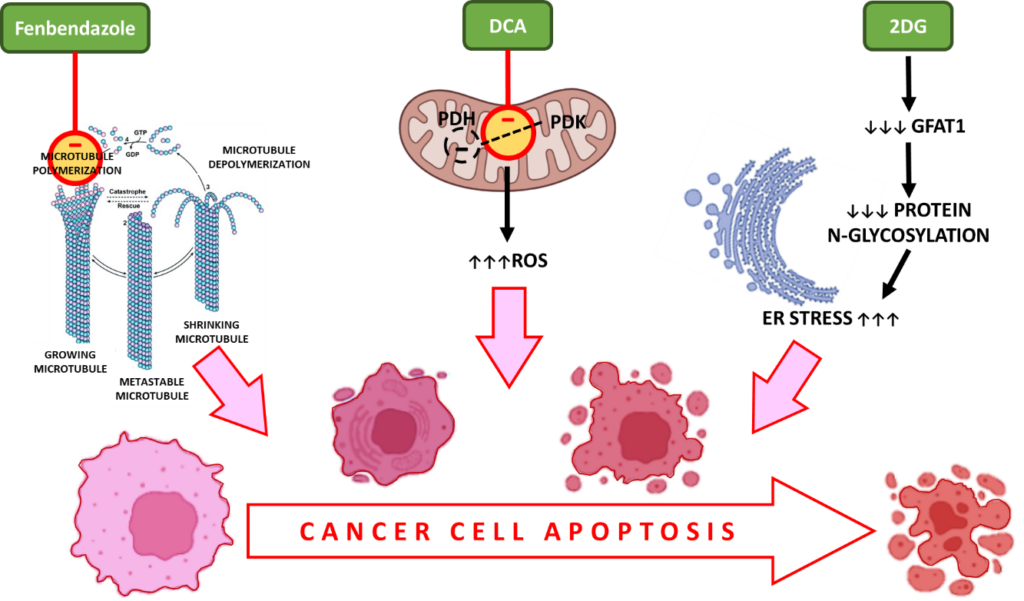
i. Fenbendazol – interagerar med β-tubulin för att förhindra polymerisering för att bilda mikrotubuli vilket leder till cellcykelstopp och apoptotisk celldöd
Under celldelningen bildar mikrotubuli, som består av tubulinsubenheter, spindlar för att möjliggöra korrekt kromosomsegregering. FBZ stör tubulinpolymeriseringen, ett viktigt steg under celldelningen, och säkerställer att cellcykeln stannar i aktivt delande cancerceller.
Oavsett om FBZ hämmar ökat upptag av glukos eller riktar in sig på mikrotubuli för att stoppa okontrollerad celldelning, utlöser det apoptos av cancerceller som ett vanligt slutresultat.
ii. DCA – ökar reaktiva syreföreningar (ROS) i cancerceller, oxidativ stress, caspase-aktivering och apoptos
Dichloroacetate (DCA) är en hämmare av pyruvatdehydrogenaskinaset (PDK) som fosforylerar PDH till fosfo-PDH, det aktiva substratet i aerob glykolys.13
Hämning av PDK och aktivering av PDH har rapporterats vara förknippade med ökad produktion av reaktiva syreföreningar (ROS). ROS orsakar dubbelsträngsbrott i cancercellernas DNA och ökar deras känslighet för strålbehandling och apoptos.
iii. 2-DG – berövar cancerceller näringsämnen, orsakar oxidativ stress och apoptotisk celldöd
Eftersom 2DG efterliknar förhållanden med glukosbrist hämmar det aerob glykolys, vilket i slutändan leder till näringsbrist och celldöd.
GFAT1 är dessutom en gen som spelar en viktig roll vid proteinglykosylering och är avgörande för cancercellernas metabolism. Administrering av 2DG minskar GFAT1 på ett dosberoende sätt, vilket leder till störningar i proteinernas N-glykosylering. Detta orsakar ER-stress-inducerad celldöd hos cancerceller.
Framkallande Av Apoptos I Cancer Med Fenbendazol, DCA Och 2-DG
c) Hur de 3 läkemedlen kompletterar standardbehandlingar mot cancer för att uppnå ytterligare synergistiska effekter
i. Fenbendazol – låg biverkningsprofil, därför lätt att administrera tillsammans med traditionella behandlingar och uppnå synergistiska effekter
En annan viktig aspekt av FBZ är dess höga säkerhetsmarginal, låga toxicitet och minimala läkemedelsresistens jämfört med andra kemoterapeutiska medel som taxaner och vinkaalkaloider som också stör tubulinpolymerisation och stoppar celldelning men orsakar akut toxicitet hos människor.
Dessutom minskar FBZ bildandet av nya blodkärl via angiogenes och hämmar tumörtillväxten i lungcancerceller.
ii. DCA – Reverserar resistens mot kemoterapi och strålbehandling
DCA-behandling hämmar pyruvatdehydrogenaskinas (PDK). Minskad PDH-fosforylering av PDK minskar fosforylerat pyruvatdehydrogenas (pPDH), sänker aerob glykolys, laktatproduktion och extracellulär försurningshastighet (ECAR).
Genom att störa den aeroba glykolysen gör DCA cancercellerna mer känsliga för kemoterapeutiska läkemedel medan ökade ROS gör cancercellerna mer strålningskänsliga. En studie som utfördes på lung- och levercancerceller visade att samtidig administrering av DCA och paklitaxel, ett kemoterapeutiskt medel, ökade den apoptotiska celldöden i cancercellerna.
iii. 2-DG – saktar ner metaboliskt överaktiva cancerceller och gör dem mer sårbara för traditionella behandlingar
2DG är också känt för att inducera uttrycket av thioredoxin interacting protein (TXNIP), som är ett tumörhämmande protein. På så sätt ökar det cancercellernas kemokänslighet och strålningskänslighet.
Detta leder i sin tur till ökad apoptotisk celldöd som svar på dessa konventionella behandlingar. På så sätt fungerar 2-DG som en kemoterapi- och strålbehandlingssensibilisator i cancerceller.
Bekämpning av cancer med fenbendazol, DCA och 2-DG för att övervinna metabolisk omprogrammering
Det för närvarande rådande paradigmet för cancerbehandling bygger till stor del på kirurgi, strålbehandling och kemoterapi. Denna traditionellt använda kombination har i många fall varit framgångsrik när det gäller att hejda cancerutvecklingen och har i vissa fall till och med varit framgångsrik när det gäller att effektivt bota patienter.
Men för de patienter som antingen diagnostiseras i ett avancerat och/eller metastaserande sjukdomsstadium, eller de som olyckligtvis utvecklas till ett avancerat och/eller metastaserande sjukdomsstadium, har ovanstående kombinationsstrategi i stort sett varit ineffektiv. Anledningen är att cancerceller, när de ställs inför en nära förestående död på grund av terapeutiskt tryck, ganska ofta kan anpassa sig genom en process som kallas metabolisk omprogrammering, där de lär sig att utnyttja typiska cellulära energikällor, som glukos, på ett sätt som gör dem resistenta mot kemoterapi.
Och tills denna metaboliska anpassning kan angripas kommer behandlingarna i stort sett att förbli ineffektiva för avancerad och/eller metastaserande cancer. Lyckligtvis finns det redan säkra och effektiva läkemedel mot metabol omprogrammering som för närvarande är tillgängliga för cancerpatienter. Tre sådana läkemedel är Fenbendazole, DCA och 2-DG som var för sig verkar genom en rad olika mekanismer.
När de används i kombination har de ofta synergistiska effekter och kan vara ännu mer effektiva än när de används var för sig. Dessutom utesluter deras användning inte standardbehandlingar som kemoterapi eller strålterapi.
Baserat på tillgängliga data förväntas administrering av Fenbendazole, DCA och/eller 2-DG tillsammans med traditionella behandlingar förbättra den totala effekten av cancerbehandling, särskilt i avancerade och/eller metastatiska fall.
Framtidsutsikter
Medan kliniska studier och prövningar pågår för att bättre förstå hur dessa tre läkemedel kan användas ytterligare för terapeutisk nytta, är de för närvarande tillgängliga för patienter idag för att kombineras i behandlingsregimer.
Referenser:
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
- Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer. Nature. 2019 Nov;575(7782):299-309. doi: 10.1038/s41586-019-1730-1. Epub 2019 Nov 13. PMID: 31723286; PMCID: PMC8008476.
- Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020 May 2;21(9):3233. doi: 10.3390/ijms21093233. PMID: 32370233; PMCID: PMC7247559.
- Nong S, Han X, Xiang Y, Qian Y, Wei Y, Zhang T, Tian K, Shen K, Yang J, Ma X. Metabolic reprogramming in cancer: Mechanisms and therapeutics. MedComm (2020). 2023 Mar 27;4(2):e218. doi: 10.1002/mco2.218. PMID: 36994237; PMCID: PMC10041388.
- Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
- Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
- Fu L, Jin W, Zhang J, Zhu L, Lu J, Zhen Y, Zhang L, Ouyang L, Liu B, Yu H. Repurposing non-oncology small-molecule drugs to improve cancer therapy: Current situation and future directions. Acta Pharm Sin B. 2022 Feb;12(2):532-557. doi: 10.1016/j.apsb.2021.09.006. Epub 2021 Sep 10. PMID: 35256933; PMCID: PMC8897051.
- Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep. 2018 Aug 9;8(1):11926. doi: 10.1038/s41598-018-30158-6. PMID: 30093705; PMCID: PMC6085345.
- Park D, Lee JH, Yoon SP. Anti-cancer effects of fenbendazole on 5-fluorouracil-resistant colorectal cancer cells. Korean J Physiol Pharmacol. 2022 Sep 1;26(5):377-387. doi: 10.4196/kjpp.2022.26.5.377. PMID: 36039738; PMCID: PMC9437363.
- Song B, Park EY, Kim KJ, Ki SH. Repurposing of Benzimidazole Anthelmintic Drugs as Cancer Therapeutics. Cancers (Basel). 2022 Sep 22;14(19):4601. doi: 10.3390/cancers14194601. PMID: 36230527; PMCID: PMC9559625.
- Tataranni T, Piccoli C. Dichloroacetate (DCA) and Cancer: An Overview towards Clinical Applications. Oxid Med Cell Longev. 2019 Nov 14;2019:8201079. doi: 10.1155/2019/8201079. PMID: 31827705; PMCID: PMC6885244.
- Parczyk J, Ruhnau J, Pelz C, Schilling M, Wu H, Piaskowski NN, Eickholt B, Kühn H, Danker K, Klein A. Dichloroacetate and PX-478 exhibit strong synergistic effects in a various number of cancer cell lines. BMC Cancer. 2021 Apr 30;21(1):481. doi: 10.1186/s12885-021-08186-9. PMID: 33931028; PMCID: PMC8086110.
- O’Neill S, Porter RK, McNamee N, Martinez VG, O’Driscoll L. 2-Deoxy-D-Glucose inhibits aggressive triple-negative breast cancer cells by targeting glycolysis and the cancer stem cell phenotype. Sci Rep. 2019 Mar 7;9(1):3788. doi: 10.1038/s41598-019-39789-9. PMID: 30846710; PMCID: PMC6405919.
- Pajak B, Siwiak E, Sołtyka M, Priebe A, Zieliński R, Fokt I, Ziemniak M, Jaśkiewicz A, Borowski R, Domoradzki T, Priebe W. 2-Deoxy-d-Glucose and Its Analogs: From Diagnostic to Therapeutic Agents. Int J Mol Sci. 2019 Dec 29;21(1):234. doi: 10.3390/ijms21010234. PMID: 31905745; PMCID: PMC6982256.
- Zhang D, Li J, Wang F, Hu J, Wang S, Sun Y. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014 Dec 28;355(2):176-83. doi: 10.1016/j.canlet.2014.09.003. Epub 2014 Sep 10. PMID: 25218591.