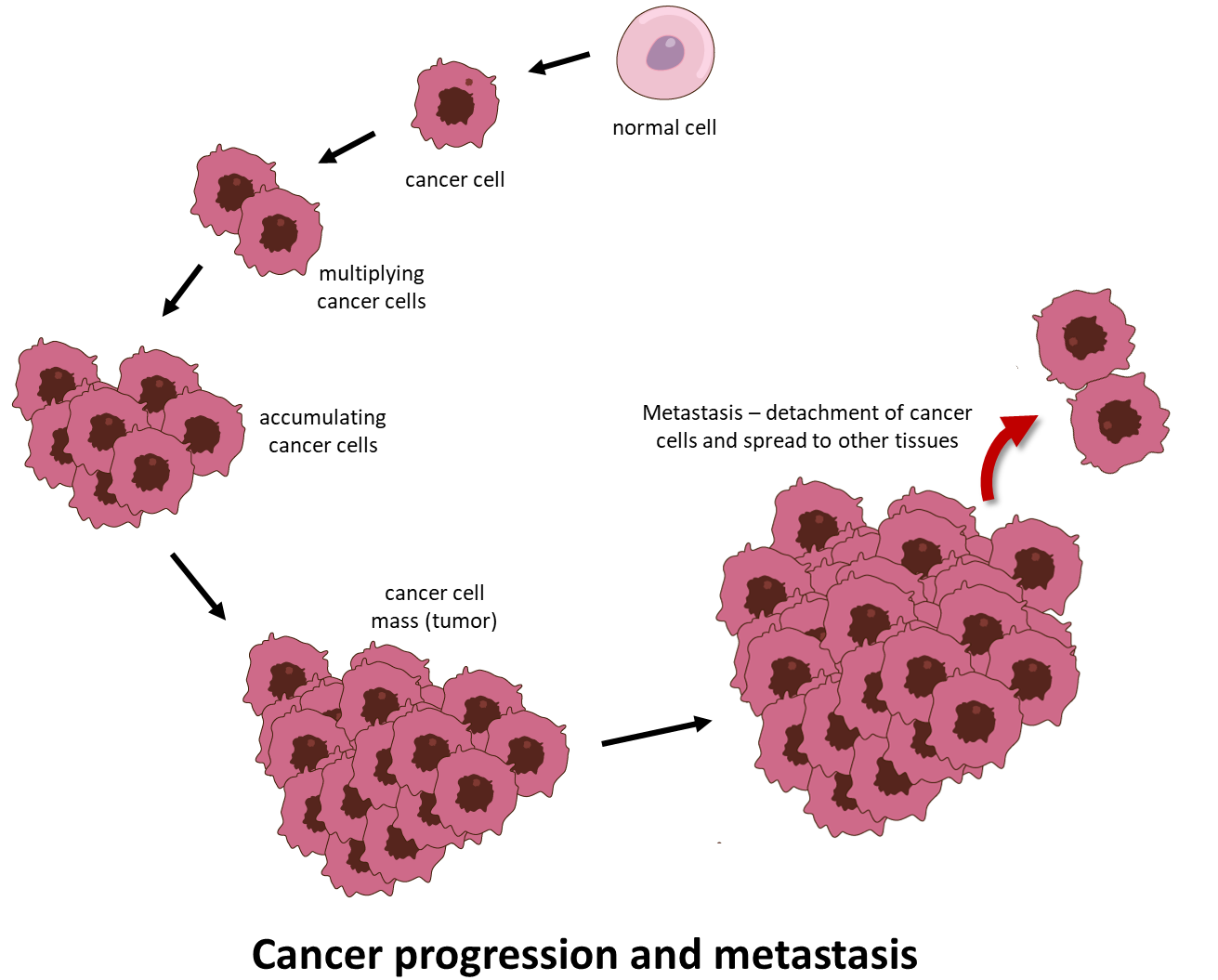
El cáncer es una enfermedad desalentadora en la que células anormales se dividen sin control y adquieren la capacidad de propagarse más allá de su lugar de origen, infiltrándose y destruyendo tejidos y órganos corporales distantes. Este último proceso se denomina metástasis y es la causa más frecuente de muerte por cáncer (Figura 1).
En 2020, se registraron 19,3 millones de nuevos casos de cáncer en todo el mundo, de los cuales se estimaron 10 millones de muertes.1 Los rápidos avances en la investigación del cáncer en las últimas cinco décadas han revelado el hecho de que durante la tumorigénesis, las células cancerosas adquieren alteraciones en la fisiología celular que las diferencian de las células normales. Estas capacidades adquiridas, también conocidas como rasgos distintivos del cáncer (Figure 2) son compartidas por todos los tipos de cáncer.2 Estos rasgos compartidos incluyen:
- Autosuficiencia en señales de crecimiento. A diferencia de las células normales, las células cancerosas no dependen de factores de crecimiento exógenos para su proliferación activa. En su lugar, adquieren la capacidad de sintetizar factores de crecimiento a los que son sensibles, creando un bucle de señalización de retroalimentación positiva.
- Evasión de los supresores del crecimiento. A diferencia de las células normales, en las que actúan múltiples inhibidores solubles del crecimiento antiproliferativo para mantener la quiescencia celular y la homeostasis tisular, las células cancerosas aprenden de algún modo a evadir las señales antiproliferativas que frenan el crecimiento celular. Por tanto, las células cancerosas siguen proliferando incluso en presencia de supresores del crecimiento..
- Resistencia a la muerte celular. Las células cancerosas se oponen a las vías naturales de muerte celular que eliminan las células innecesarias o potencialmente peligrosas.
- Angiogénesis. Las células cancerosas crecen rápidamente vasos sanguíneos a través de la angiogénesis para conectarse al sistema circulatorio y acceder al oxígeno y los nutrientes para sobrevivir y proliferar.
- Sión y metástasis. Las células cancerosas se trasladan del sitio primario a lugares distantes a) para evadir la vigilancia inmunológica, b) para superar la falta de oxígeno y nutrientes necesarios debido al gran tamaño del tumor, c) para escapar de la muerte celular causada por la acumulación de exceso de ácido láctico.
- Evasión inmunitaria. Los tumores pueden eludir los ataques del sistema de vigilancia inmunitaria a través de varios mecanismos, como restringir el reconocimiento de antígenos, es decir, engañar al sistema inmunitario para que no reconozca las células cancerosas rebeldes e inducir el agotamiento de las células T, los soldados del sistema inmunitario que reconocen las células cancerosas rebeldes.
- Inflamación promotora de tumores. En una respuesta inflamatoria normal, las células inmunitarias producen sustancias químicas que matan a un patógeno. Estas sustancias químicas, conocidas como especies reactivas del oxígeno, también pueden dañar el ADN de las células normales, lo que a su vez aumenta el riesgo de mutaciones y, posteriormente, impulsa el desarrollo del cáncer debido a la inflamación crónica.
- Mutación(es) e inestabilidad genómica. Esto ocurre debido a la mayor tendencia a la alteración del genoma durante la división celular. La replicación aberrante del ADN contribuye a la adquisición de mutaciones y de un genoma inestable que, a su vez, conduce al desarrollo de neoplasias.
- Reprogramación epigenética. Se trata de cambios en la estructura subyacente de la cromatina de un gen. Estos cambios pueden activar un oncogén cancerígeno o desactivar un gen supresor de tumores y contribuir al proceso de tumorigénesis.
- Genomas polimórficos. O variaciones genéticas en genes que regulan la reparación de los desajustes del ADN, la regulación del ciclo celular, el metabolismo y la inmunidad aumentan la susceptibilidad al cáncer.
- Plasticidad fenotípica. La capacidad de las células cancerosas de experimentar cambios dinámicos en su forma, tamaño, morfología, etc., contribuye a la evasión inmunitaria y a la resistencia a los fármacos, y favorece la invasión y la migración a distancia de las células cancerosas.
- Reprogramación metabólica. Capacidad de las células cancerosas de alterar su metabolismo para satisfacer la mayor demanda de energía de las células cancerosas en rápida proliferación y, de este modo, convertirse en «inmortales».
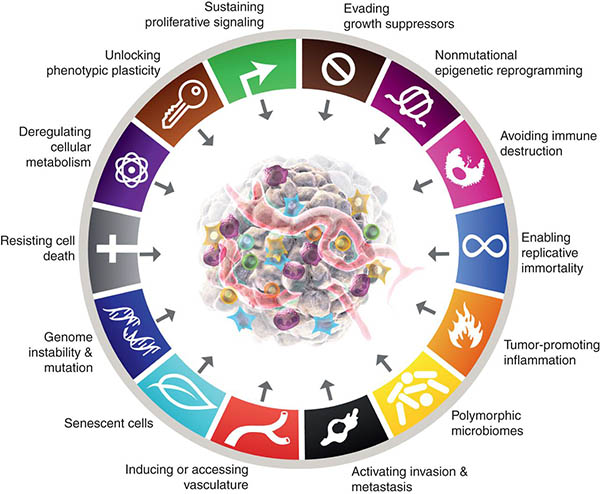
(Imagen cortesía de Cancer Discovery Journal https://www.aacr.org/blog/2022/01/21/new-dimensions-in-cancer-biology-updated-hallmarks-of-cancer-published/)
Retos Actuales Para Encontrar El Tratamiento Oncológico Adecuado
Dado que existen múltiples factores posibles que impulsan la transformación de células normales en células cancerosas malignas, la prevención sigue siendo muy difícil y la erradicación del cáncer una vez que ya está establecido sigue planteando innumerables retos. Las terapias convencionales contra el cáncer, como la quimioterapia y la radioterapia, se dirigen principalmente a las células en proliferación activa.
Los fármacos quimioterapéuticos no diferencian entre células normales en división activa y células cancerosas. Por lo tanto, se observan efectos tóxicos graves en los pacientes debido a la pérdida inadvertida pero inevitable de células normales. Esto provoca neurotoxicidad, cardiotoxicidad, toxicidad gastrointestinal e inmunodepresión. Además, los fármacos quimioterapéuticos suelen asociarse a resistencias.3,4
Por lo tanto, muchos pacientes de cáncer cuya enfermedad reaparece tras una breve remisión necesitan urgentemente medicamentos alternativos que también aborden otras características del cáncer y causen menos toxicidad.
Reprogramación Metabólica: La Clave Del Fracaso De Las Terapias Actuales Contra El Cáncer
La glucosa es la principal fuente de energía de las células eucariotas normales no cancerosas. Durante el metabolismo de la glucosa, las células normales producen CO2 a través de la fosforilación oxidativa en condiciones aeróbicas o lactato a través de la glucólisis en condiciones anaeróbicas. En las células cancerosas, el cambio metabólico hacia un consumo excesivo de glucosa -más de 200 veces la tasa normal, lo que se conoce como glucólisis aeróbica o efecto Warburg- desempeña un papel fundamental.5,6
A diferencia de los tejidos normales, donde las células sólo presentan glucólisis en condiciones de oxígeno limitado o aneróbicas, las células cancerosas reprograman la ruta metabólica para llevar a cabo la glucólisis incluso en condiciones aeróbicas para satisfacer la alta demanda de energía de la división celular incontrolada; esto se denomina efecto Warburg o glucólisis aeróbica y es un rasgo crítico que distingue a las células cancerosas de las células normales.
Esta alteración metabólica conduce a una sobreproducción de lactato, que es expulsado de las células. Esta expulsión conduce a la acumulación de ácido láctico, que promueve la acidificación del microambiente tumoral, una condición que puede suprimir el sistema inmunitario y reducir potencialmente la eficacia de ciertos tratamientos de inmunoterapia.
¿Por Qué Son Ineficaces Las Dietas Cetogénicas/Bajas En Azúcar?
Además, estrategias como las dietas cetogénicas o la evitación del azúcar suelen ser ineficaces en este contexto. Estos enfoques suelen acelerar la caquexia, una forma grave de pérdida muscular y de peso, acelerando la progresión hacia la mortalidad.7
Esta ineficacia se debe principalmente a que las células cancerosas son expertas en extraer nutrientes esenciales de los músculos (especialmente la glutamina) y otros tejidos para su sustento, socavando así el impacto previsto de las restricciones dietéticas.
Reutilización De Fármacos No Oncológicos Para Combatir El Cáncer
El desarrollo de nuevos fármacos contra el cáncer es cada vez más difícil y costoso. Para encontrar una cura terapéutica eficaz contra el cáncer, están resultando muy útiles los fármacos ya aprobados clínicamente o probados experimentalmente para afecciones distintas del cáncer, pero que poseen una citotoxicidad no reconocida previamente contra las células malignas.
Los investigadores del cáncer han identificado ciertas moléculas de fármacos que podrían servir como candidatos adecuados contra el cáncer junto con las terapias convencionales. Por lo tanto, la reutilización de fármacos con eficacia anticancerígena puede considerarse una estrategia importante para el tratamiento del cáncer en la actualidad.8
Debido al mecanismo de reprogramación metabólica descrito anteriormente, por el que suelen fracasar las terapias estándar contra el cáncer, lo más lógico sería centrarse en candidatos a fármacos reorientados que combatan este mismo mecanismo. Por lo tanto, aunque existen muchos fármacos prometedores para complementar las terapias anticancerígenas existentes, hay razones de peso para centrarse en aquellos fármacos que superan una característica específica del cáncer en particular: la reprogramación metabólica.
Fármacos que ayudan a superar la reprogramación metabólica en el cáncer: Fenbendazol, dicloroacetato sódico (DCA) y 2-deoxi-d-glucosa (2-DG)
a) Cómo los 3 fármacos tienen mecanismos únicos, independientes y sinérgicos para combatir el consumo excesivo de glucosa en las células cancerosas:
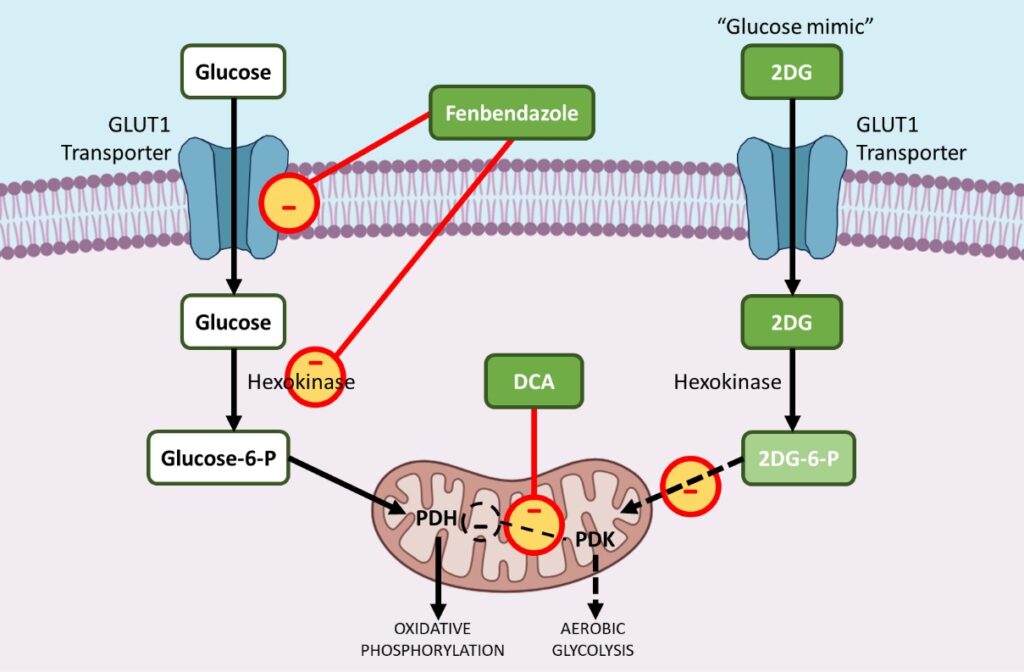
i. Fenbendazol – reduce los transportadores GLUT y afecta a la hexoquinasa 2
El fenbendazol (FBZ) (metil N-(6-fenilsulfanil-1H-benzimidazol-2-il) carbamato) es una clase de fármacos de benzimidazol, que se utiliza como medicamento contra el cáncer. El FBZ tiene un efecto anticancerígeno demostrado, ya que detiene la proliferación celular, reduce la captación de glucosa y desencadena la muerte celular apoptótica.9 ,10,11
La reutilización del fenbendazol es, por tanto, una opción importante en la terapia del cáncer que puede reducir considerablemente el tiempo y los costes necesarios para desarrollar nuevos fármacos.
El cáncer se asocia a un trastorno metabólico en el que las células cancerosas prefieren selectivamente la ineficiente glucólisis aeróbica (que genera sólo 2 moléculas de ATP) a la fosforilación oxidativa mitocondrial (que genera 38 moléculas de ATP) para satisfacer sus necesidades energéticas. La glucólisis aeróbica es un proceso energéticamente ineficiente, por lo que las células cancerosas necesitan multiplicar varias veces su consumo de glucosa.
Las células cancerosas aumentan la captación de glucosa mediante la regulación al alza de GLUT1, una proteína de membrana que facilita la captación basal de glucosa. El tratamiento con FBZ reduce la captación de glucosa en las células cancerosas debido a la regulación a la baja de los transportadores GLUT y otras enzimas glucolíticas clave como la Hexoquinasa II (HKII).
Con el fin de impulsar la glucólisis aeróbica, muchas enzimas glucolíticas se regulan al alza durante la tumorigénesis. La hexoquinasa II (HKII), una enzima glucolítica clave, desempeña un papel fundamental en la retención y el metabolismo de la glucosa al fosforilar la glucosa en glucosa-6-fosfato, que puede entrar en la glucólisis.
Así pues, la HKII es una enzima muy ventajosa para la supervivencia y proliferación de las células cancerosas. La FBZ deteriora la función enzimática de la HKII en las células cancerosas, lo que reduce la retención de glucosa en las células tratadas con FBZ y, finalmente, las células cancerosas mueren porque no pueden utilizar la glucosa como fuente de energía a través de la glucólisis aeróbica.11
Superación De La Programación Metabólica En El Cáncer Con Fenbendazol, DCA Y 2-DG
ii. DCA – inhibe la piruvato deshidrogenasa quinasa (PDK)
El dicloroacetato sódico (DCA), una pequeña molécula ya utilizada para tratar la acidosis láctica aguda y crónica, se ha reutilizado en gran medida como medicamento contra el cáncer.12,13
Las células cancerosas obtienen energía de la glucólisis excesiva en lugar de la fosforilación oxidativa mitocondrial. Al estimular la glucólisis aeróbica y aumentar la acidez del microambiente tumoral, las células cancerosas tienen una clara ventaja. La acidosis metabólica en el microambiente tumoral inhibe la apoptosis o los mecanismos naturales de muerte celular y ayuda a crear resistencia contra los fármacos.
Durante la carcinogénesis, la mayoría de las enzimas glicolíticas se regulan al alza, mientras que las enzimas que ayudan a la fosforilación oxidativa en las mitocondrias se regulan preferentemente a la baja. La piruvato deshidrogenasa cinasa (PDK) es una enzima que regula el flujo de glucosa hacia la mitocondria, sede de la fosforilación oxidativa. En presencia de PDK activada, se inhibe la piruvato deshidrogenasa (PDH), una enzima favorable a la fosforilación oxidativa, lo que limita la entrada de piruvato en la mitocondria, donde puede tener lugar la oxidación de la glucosa.
Esto desplaza el metabolismo hacia la glucólisis. El DCA actúa selectivamente sobre las células cancerosas desplazando su metabolismo de la glucólisis a la fosforilación oxidativa mediante la inhibición de la piruvato deshidrogenasa cinasa (PDK), el inhibidor de la piruvato deshidrogenasa (PDH).
La activación de las enzimas PDH favorece la fosforilación oxidativa en lugar de la glucólisis aeróbica, la vía preferida a través de la cual las células cancerosas satisfacen esta elevada demanda energética, alterando así la ventaja metabólica de las células cancerosas y haciéndolas más sensibles a los fármacos quimioterapéuticos.
iii. 2-DG: un análogo o «imitador» de la glucosa que bloquea enzimas clave como la hexoquinasa y la glucosa-6-fosfato isomerasa.
2-deoxy-D-glucose (2-DG) (2-DG) es un análogo natural no metabolizable de la glucosa, cuyo grupo 2-hidroxilo ha sido sustituido por hidrógeno. La 2DG inhibe competitivamente la captación de glucosa porque tanto la glucosa como la 2-DG son transportadas al interior de la célula por la enzima transportadora de glucosa (GLUT1). 14,15,16
Cuando se transporta menos glucosa al interior de la célula cancerosa, puede producirse menos glucólisis aeróbica. La reducción de la glucólisis detiene en última instancia la proliferación celular activa de las células cancerosas.
En segundo lugar, tras entrar en la célula, la hexoquinasa fosforila tanto la glucosa como la 2DG para formar glucosa-6-fosfato y 2-Deoxi-D-glucosa-6-fosfato (2DG-6-P) respectivamente.
La 2DG-6-P no puede seguir metabolizándose a través de la glucólisis. Como tal, actúa inhibiendo competitivamente la producción de glucosa-6-fosfato a partir de glucosa durante la glucólisis y, de este modo, inhibe el metabolismo de la glucosa en las células cancerosas.
b) Cómo los 3 fármacos tienen mecanismos únicos, independientes y sinérgicos para inducir apoptosis selectiva en células cancerosas pero no en células normales.
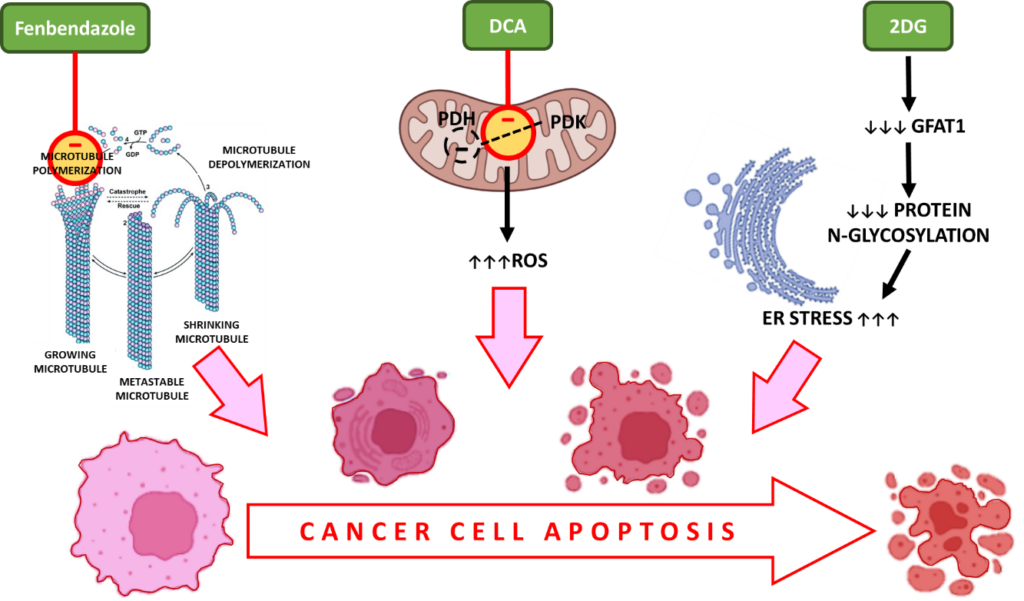
i. Fenbendazol: interactúa con la β-tubulina para impedir la polimerización para formar microtúbulos, lo que provoca la detención del ciclo celular y la muerte celular apoptótica.
Durante la división celular, los microtúbulos, formados por subunidades de tubulina, forman husos que permiten la correcta segregación cromosómica. El FBZ interrumpe la polimerización de la tubulina, un paso esencial durante la proliferación celular, asegurando la detención del ciclo celular en las células cancerosas en división activa.
Ya sea inhibiendo el aumento de la captación de glucosa o dirigiéndose a los microtúbulos para detener la división celular incontrolada, el FBZ desencadena la apoptosis de las células cancerosas como resultado final común.
ii. DCA – aumenta las especies reactivas del oxígeno (ROS) en las células cancerosas, el estrés oxidativo, la activación de la caspasa y la apoptosis.
El dicloroacetato (DCA) es un inhibidor de la piruvato deshidrogenasa cinasa (PDK) que fosforila la PDH a fosfo PDH, el sustrato activo en la glucólisis aeróbica.13
La inhibición de la PDK y la activación de la PDH están asociadas a una mayor producción de especies reactivas del oxígeno (ROS). Las ROS inducen roturas de doble cadena en el ADN de las células cancerosas y aumentan su sensibilidad a la radioterapia y a la apoptosis.
iii. 2-DG: priva a las células cancerosas de nutrientes, provoca estrés oxidativo y muerte celular apoptótica.
Dado que la 2DG imita las condiciones de privación de glucosa, inhibe la glucólisis aeróbica, lo que en última instancia conduce a la privación de nutrientes y a la muerte celular.
Además, el GFAT1 es un gen que desempeña un papel importante en la glicosilación de proteínas y es esencial para el metabolismo de las células cancerosas. La administración de 2DG disminuye la GFAT1 de forma dependiente de la dosis, lo que provoca una alteración de la N-glicosilación de las proteínas. Esto provoca la muerte celular de las células cancerosas inducida por el estrés RE.
Inducción de la apoptosis en el cáncer con fenbendazol, DCA y 2-DG
c) Cómo los 3 fármacos complementan los tratamientos oncológicos estándar para ejercer más efectos sinérgicos.
i. Fenbendazol: bajo perfil de efectos secundarios, por lo que es fácil de coadministrar con tratamientos tradicionales y obtener efectos sinérgicos.
Otro aspecto importante del FBZ es su alto margen de seguridad, baja toxicidad y mínima resistencia a los fármacos en comparación con otros agentes quimioterapéuticos como los taxanos y los alcaloides de la vinca, que también interrumpen la polimerización de la tubulina y detienen la división celular, pero causan toxicidad aguda en humanos.
Además, el FBZ también demuestra la reducción de la formación de nuevos vasos sanguíneos a través de la angiogénesis y la inhibición del crecimiento tumoral en células de cáncer de pulmón.
ii. DCA – Invierte la resistencia a la quimioterapia y la radioterapia
El tratamiento con DCA inhibe la piruvato deshidrogenasa cinasa (PDK). La disminución de la fosforilación de la PDH por la PDK reduce la piruvato deshidrogenasa fosforilada (pPDH), disminuye la glucólisis aeróbica, la producción de lactato y la tasa de acidificación extracelular (ECAR).
Al interrumpir la glucólisis aeróbica, el DCA hace que las células cancerosas sean más sensibles a los fármacos quimioterapéuticos, mientras que el aumento de ROS confiere a las células cancerosas una mayor sensibilidad a la radiación. Un estudio realizado en células de cáncer de pulmón y de hígado demostró que la administración conjunta de DCA con paclitaxel, un agente quimioterapéutico, aumentaba la muerte celular apoptótica en las células cancerosas.
iii. 2-DG: ralentiza las células cancerosas metabólicamente hiperactivas y las hace más vulnerables a los tratamientos tradicionales.
También se sabe que la 2DG induce la expresión de la proteína que interactúa con la tiorredoxina (TXNIP), que es una proteína supresora de tumores. Al hacerlo, aumenta la quimiosensibilidad y la sensibilidad a la radiación de las células cancerosas.
Esto, a su vez, provoca un aumento de la muerte celular apoptótica en respuesta a estos tratamientos convencionales. Como tal, la 2-DG actúa como un sensibilizador a la quimioterapia y a la radioterapia en las células cancerosas.
Lucha contra el cáncer con fenbendazol, DCA y 2-DG para superar la reprogramación metabólica
El paradigma que prevalece actualmente para el tratamiento del cáncer depende en gran medida de la cirugía, la radioterapia y la quimioterapia. Este enfoque combinado empleado tradicionalmente ha conseguido frenar la progresión del cáncer en muchos casos e incluso en algunos ha logrado curar eficazmente a los pacientes.
Sin embargo, en el caso de los pacientes diagnosticados en estadios avanzados y/o metastásicos de la enfermedad, o de aquellos que desgraciadamente progresan a estadios avanzados y/o metastásicos de la enfermedad, el enfoque combinado anterior ha sido en gran medida ineficaz. La razón es que las células cancerosas, cuando se enfrentan a una muerte inminente debido a la presión terapéutica, muy a menudo pueden adaptarse a través de un proceso llamado Reprogramación Metabólica en el que aprenden a utilizar diferencialmente las fuentes típicas de energía celular, como la glucosa, de una manera que las hace resistentes a la quimioterapia.
Y hasta que no se consiga atajar esta adaptación metabólica, los tratamientos seguirán siendo en gran medida ineficaces para los cánceres avanzados y/o metastásicos. Por suerte, ya existen fármacos seguros y eficaces para superar la reprogramación metabólica, y actualmente están a disposición de los pacientes con cáncer. Tres de estos fármacos son el Fenbendazol, el DCA y la 2-DG, que actúan individualmente a través de diversos mecanismos.
Cuando se utilizan en combinación, a menudo ejercen efectos sinérgicos y pueden ser incluso más eficaces que cuando se utilizan de forma independiente.
Además, su uso no excluye la utilización de tratamientos estándar como la quimioterapia o la radioterapia.
Según los datos disponibles, se prevé que la administración de fenbendazol, DCA y/o 2-DG junto con los tratamientos tradicionales mejore la eficacia general del tratamiento del cáncer, especialmente en el contexto avanzado y/o metastásico.
Perspectivas de futuro
Aunque se están llevando a cabo estudios y ensayos clínicos para comprender mejor cómo se pueden utilizar estos tres fármacos para obtener beneficios terapéuticos, ya están disponibles para que los pacientes los combinen en regímenes de tratamiento.
Referencias:
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
- Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer. Nature. 2019 Nov;575(7782):299-309. doi: 10.1038/s41586-019-1730-1. Epub 2019 Nov 13. PMID: 31723286; PMCID: PMC8008476.
- Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020 May 2;21(9):3233. doi: 10.3390/ijms21093233. PMID: 32370233; PMCID: PMC7247559.
- Nong S, Han X, Xiang Y, Qian Y, Wei Y, Zhang T, Tian K, Shen K, Yang J, Ma X. Metabolic reprogramming in cancer: Mechanisms and therapeutics. MedComm (2020). 2023 Mar 27;4(2):e218. doi: 10.1002/mco2.218. PMID: 36994237; PMCID: PMC10041388.
- Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
- Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
- Fu L, Jin W, Zhang J, Zhu L, Lu J, Zhen Y, Zhang L, Ouyang L, Liu B, Yu H. Repurposing non-oncology small-molecule drugs to improve cancer therapy: Current situation and future directions. Acta Pharm Sin B. 2022 Feb;12(2):532-557. doi: 10.1016/j.apsb.2021.09.006. Epub 2021 Sep 10. PMID: 35256933; PMCID: PMC8897051.
- Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep. 2018 Aug 9;8(1):11926. doi: 10.1038/s41598-018-30158-6. PMID: 30093705; PMCID: PMC6085345.
- Park D, Lee JH, Yoon SP. Anti-cancer effects of fenbendazole on 5-fluorouracil-resistant colorectal cancer cells. Korean J Physiol Pharmacol. 2022 Sep 1;26(5):377-387. doi: 10.4196/kjpp.2022.26.5.377. PMID: 36039738; PMCID: PMC9437363.
- Song B, Park EY, Kim KJ, Ki SH. Repurposing of Benzimidazole Anthelmintic Drugs as Cancer Therapeutics. Cancers (Basel). 2022 Sep 22;14(19):4601. doi: 10.3390/cancers14194601. PMID: 36230527; PMCID: PMC9559625.
- Tataranni T, Piccoli C. Dichloroacetate (DCA) and Cancer: An Overview towards Clinical Applications. Oxid Med Cell Longev. 2019 Nov 14;2019:8201079. doi: 10.1155/2019/8201079. PMID: 31827705; PMCID: PMC6885244.
- Parczyk J, Ruhnau J, Pelz C, Schilling M, Wu H, Piaskowski NN, Eickholt B, Kühn H, Danker K, Klein A. Dichloroacetate and PX-478 exhibit strong synergistic effects in a various number of cancer cell lines. BMC Cancer. 2021 Apr 30;21(1):481. doi: 10.1186/s12885-021-08186-9. PMID: 33931028; PMCID: PMC8086110.
- O’Neill S, Porter RK, McNamee N, Martinez VG, O’Driscoll L. 2-Deoxy-D-Glucose inhibits aggressive triple-negative breast cancer cells by targeting glycolysis and the cancer stem cell phenotype. Sci Rep. 2019 Mar 7;9(1):3788. doi: 10.1038/s41598-019-39789-9. PMID: 30846710; PMCID: PMC6405919.
- Pajak B, Siwiak E, Sołtyka M, Priebe A, Zieliński R, Fokt I, Ziemniak M, Jaśkiewicz A, Borowski R, Domoradzki T, Priebe W. 2-Deoxy-d-Glucose and Its Analogs: From Diagnostic to Therapeutic Agents. Int J Mol Sci. 2019 Dec 29;21(1):234. doi: 10.3390/ijms21010234. PMID: 31905745; PMCID: PMC6982256.
- Zhang D, Li J, Wang F, Hu J, Wang S, Sun Y. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014 Dec 28;355(2):176-83. doi: 10.1016/j.canlet.2014.09.003. Epub 2014 Sep 10. PMID: 25218591.