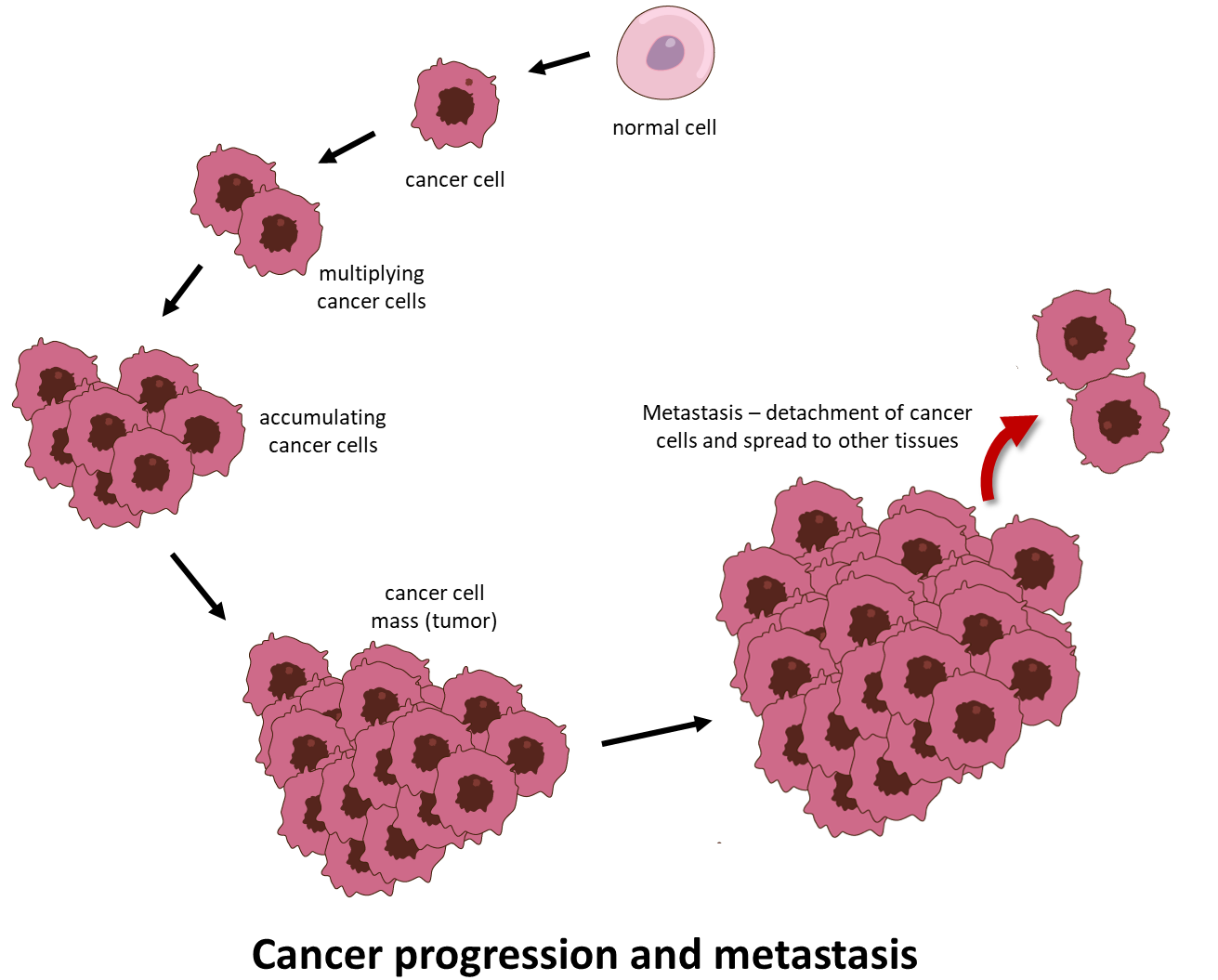
Il cancro è una malattia scoraggiante in cui le cellule anomale si dividono in modo incontrollato e acquisiscono la capacità di diffondersi oltre il sito di origine, infiltrandosi e distruggendo tessuti e organi del corpo distanti. Quest’ultimo processo è chiamato metastasi ed è la causa più comune di morte per cancro (Figure 1).
Nel 2020 sono stati segnalati 19,3 milioni di nuovi casi di cancro in tutto il mondo, di cui si è stimato uno sconcertante numero di 10,0 milioni di decessi.1 L’incidenza del cancro continua ad aumentare, così come l’incidenza dei decessi correlati al cancro. I rapidi progressi della ricerca sul cancro negli ultimi cinque decenni hanno rivelato che, durante la tumorigenesi, le cellule tumorali acquisiscono alterazioni della fisiologia cellulare che le differenziano dalle cellule normali. Queste capacità acquisite, note anche come segni distintivi del cancro (Figure 2) sono condivise da tutti i tipi di cancro.2 Questi tratti condivisi includono:
- Autosufficienza nei segnali di crescita. A differenza delle cellule normali, le cellule tumorali non dipendono da fattori di crescita esogeni per la proliferazione attiva. Al contrario, acquisiscono la capacità di sintetizzare i fattori di crescita ai quali rispondono, creando un circuito di segnalazione a feedback positivo.
- Evasione dei soppressori della crescita. A differenza delle cellule normali, in cui molteplici inibitori della crescita solubili antiproliferativi operano per mantenere la quiescenza cellulare e l’omeostasi tissutale, le cellule tumorali imparano in qualche modo a eludere i segnali antiproliferativi che rallentano la crescita cellulare. Le cellule tumorali continuano quindi a proliferare anche in presenza di soppressori della crescita.
- Resistenza alla morte cellulare. Le cellule tumorali si oppongono alle vie naturali di morte cellulare che eliminano le cellule non necessarie o potenzialmente pericolose.
- Angiogenesi. Le cellule tumorali fanno crescere rapidamente i vasi sanguigni attraverso l’angiogenesi per collegarsi al sistema circolatorio e accedere all’ossigeno e ai nutrienti per sopravvivere e proliferare.
- Invasione e metastasi. Le cellule tumorali si trasferiscono dal sito primario a sedi distanti a) per eludere la sorveglianza immunitaria, b) per superare la mancanza di ossigeno e dei nutrienti necessari a causa delle grandi dimensioni del tumore, c) per sfuggire alla morte cellulare causata dall’accumulo di acido lattico in eccesso.
- Evasione immunitaria.I tumori possono eludere gli attacchi del sistema di sorveglianza immunitaria attraverso vari meccanismi, come la limitazione del riconoscimento degli antigeni, ossia l’induzione del sistema immunitario a non riconoscere le cellule tumorali maligne e l’esaurimento dei linfociti T, i soldati del sistema immunitario che riconoscono le cellule tumorali maligne.
- Infiammazione che favorisce i tumori. In una normale risposta infiammatoria, le cellule immunitarie producono sostanze chimiche che uccidono un agente patogeno.Queste sostanze chimiche, note come specie reattive dell’ossigeno, possono anche danneggiare il DNA delle cellule normali, aumentando così il rischio di mutazioni e favorendo lo sviluppo del cancro a causa dell’infiammazione cronica.
- Mutazioni e instabilità genomica. Si verifica a causa della maggiore tendenza all’alterazione del genoma durante la divisione cellulare. La replicazione aberrante del DNA contribuisce all’acquisizione di mutazioni e a un genoma instabile, che a sua volta porta allo sviluppo di malignità.
- Riprogrammazione epigenetica. Si tratta di cambiamenti nella struttura cromatinica di un gene. Tali cambiamenti possono attivare un oncogene che causa il cancro o spegnere un gene soppressore, favorendo il processo di tumorigenesi.
- Genomi polimorfi. O variazioni genetiche nei geni che regolano la riparazione dei mismatch del DNA, la regolazione del ciclo cellulare, il metabolismo e l’immunità aumentano la suscettibilità al cancro.
- Phenotypic plasticity. Plasticità fenotipica. La capacità delle cellule tumorali di subire cambiamenti dinamici nella forma, nelle dimensioni, nella morfologia, ecc. contribuisce all’evasione immunitaria e alla resistenza ai farmaci e promuove l’invasione e la migrazione a distanza delle cellule tumorali.
- Riprogrammazione metabolica. La capacità delle cellule tumorali di alterare il proprio metabolismo per soddisfare la maggiore richiesta di energia delle cellule tumorali in rapida proliferazione e, in tal modo, di diventare “immortali”.
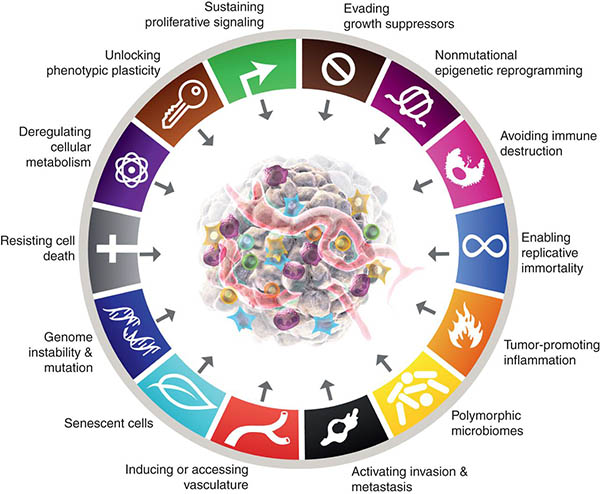
(Immagine per gentile concessione del Cancer Discovery Journal https://www.aacr.org/blog/2022/01/21/new-dimensions-in-cancer-biology-updated-hallmarks-of-cancer-published/)
Le Sfide Attuali Per Trovare Il Giusto Trattamento Del Cancro
Poiché sono molteplici i possibili fattori che guidano la trasformazione delle cellule normali in cellule tumorali maligne, la prevenzione rimane molto difficile e l’eradicazione del cancro una volta che si è già instaurato pone ancora una miriade di sfide. La terapia convenzionale del cancro, che comprende la chemioterapia e la radioterapia, colpisce principalmente le cellule in attiva proliferazione.
I farmaci chemioterapici non distinguono tra cellule normali che si dividono attivamente e cellule tumorali. Pertanto, nei pazienti si osservano gravi effetti tossici dovuti alla perdita involontaria ma inevitabile di cellule normali. Ciò comporta neurotossicità, cardiotossicità, tossicità gastrointestinale e soppressione immunitaria. Inoltre, i farmaci chemioterapici sono spesso associati alla resistenza.3,4
Pertanto, molti pazienti oncologici la cui malattia si ripresenta dopo una breve remissione hanno un disperato bisogno di farmaci alternativi che agiscano anche su altre caratteristiche del cancro e causino una minore tossicità.
Riprogrammazione Metabolica: Il Motivo Principale Del Fallimento Delle Attuali Terapie Contro Il Cancro
Il glucosio è la principale fonte di energia per le cellule normali, eucariotiche e non tumorali. Durante il metabolismo del glucosio, le cellule normali producono CO2 attraverso la fosforilazione ossidativa in condizioni aerobiche o lattato attraverso la glicolisi in condizioni anaerobiche. Nelle cellule tumorali, lo spostamento metabolico verso un consumo eccessivo di glucosio, oltre 200 volte il tasso normale, noto come glicolisi aerobica o effetto Warburg, gioca un ruolo fondamentale.5,6
A differenza dei tessuti normali, in cui le cellule presentano la glicolisi solo in condizioni di ossigeno limitato o anerobiche, le cellule tumorali riprogrammano la via metabolica per effettuare la glicolisi anche in condizioni aerobiche, al fine di soddisfare l’elevato fabbisogno energetico della divisione cellulare incontrollata; questo fenomeno è chiamato effetto Warburg o glicolisi aerobica ed è una caratteristica critica che distingue le cellule tumorali dalle cellule normali.
Questa alterazione metabolica porta a una sovrapproduzione di lattato, che viene poi espulso dalle cellule. Questa espulsione porta all’accumulo di acido lattico, che favorisce l’acidificazione del microambiente tumorale, una condizione che può sopprimere il sistema immunitario e potenzialmente ridurre l’efficacia di alcuni trattamenti immunoterapici.
Perché Le Diete A Basso Contenuto Di Zuccheri/Chetogeniche Sono Inefficaci?
Inoltre, strategie come le diete chetogeniche o la rinuncia agli zuccheri sono generalmente inefficaci in questo contesto. Questi approcci spesso accelerano la cachessia, una grave forma di perdita muscolare e di peso, accelerando la progressione verso la mortalità.7
Questa inefficacia è dovuta principalmente al fatto che le cellule tumorali sono abili nell’estrarre i nutrienti essenziali dai muscoli (in particolare la glutammina) e da altri tessuti per il loro sostentamento, compromettendo così l’impatto previsto delle restrizioni dietetiche.
Riproporre Farmaci Non Cancerogeni Per Combattere Il Cancro
Lo sviluppo di nuovi farmaci antitumorali sta diventando sempre più difficile e proibitivo dal punto di vista dei costi. Per trovare una cura terapeutica efficace per il cancro, si stanno rivelando molto utili i farmaci già approvati clinicamente o testati sperimentalmente per condizioni diverse dal cancro, ma che risultano possedere una citotossicità precedentemente non riconosciuta nei confronti delle cellule maligne.
I ricercatori sul cancro hanno identificato alcune molecole di farmaci che potrebbero fungere da candidati anti-cancro adatti alle terapie convenzionali. Pertanto, la riproposizione di farmaci con efficacia antitumorale può essere considerata oggi una strategia importante per la terapia del cancro.8
A causa del meccanismo di riprogrammazione metabolica sopra descritto, per il quale le terapie oncologiche standard tipicamente falliscono, sarebbe molto sensato concentrarsi su candidati farmaci riproposti che combattano proprio questo meccanismo. Pertanto, sebbene esistano molti candidati promettenti per integrare le terapie antitumorali esistenti, esiste un forte razionale per concentrarsi su quei farmaci che superano uno specifico segno distintivo del cancro in particolare: la riprogrammazione metabolica.
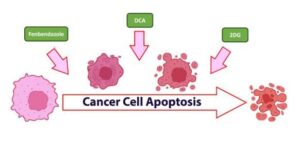
Farmaci Che Aiutano A Superare La Riprogrammazione Metabolica Nel Cancro: Fenbendazolo, dicloroacetato di sodio (DCA) e 2-deossi-d-glucosio (2-DG)
a) Come i 3 farmaci hanno meccanismi unici, indipendenti e sinergici per combattere l’eccessivo consumo di glucosio nelle cellule tumorali:
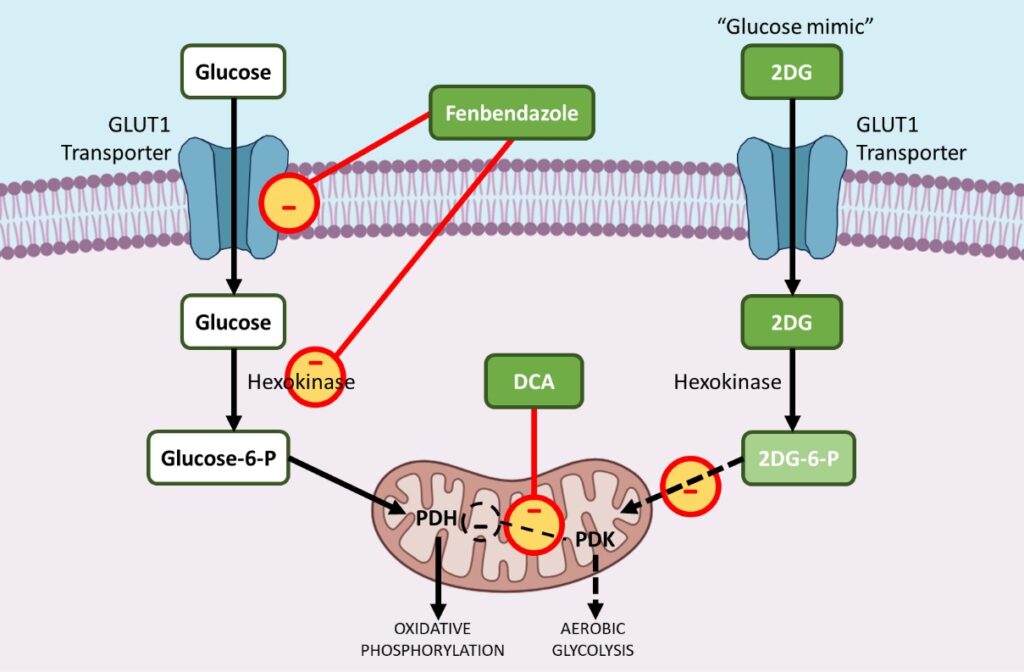
i. Fenbendazolo – riduce i trasportatori GLUT e influisce sull’esochinasi 2
Fenbendazolo – riduce i trasportatori GLUT e influisce sull’esochinasiIl fenbendazolo (FBZ) (metile N-(6-fenilsulfanil-1H-benzimidazol-2-il) carbammato) è una classe di farmaci benzimidazolici che trova impiego come antitumorale. L’FBZ ha un comprovato effetto antitumorale in quanto arresta la proliferazione cellulare, riduce l’assorbimento di glucosio e innesca la morte cellulare apoptotica.9 ,10,11
La riproposizione del fenbendazolo è quindi un’opzione importante nella terapia del cancro che può ridurre i tempi e i costi necessari per lo sviluppo di nuovi farmaci.
Il cancro è associato a un disturbo metabolico in cui le cellule tumorali preferiscono selettivamente l’inefficiente glicolisi aerobica (che genera solo 2 molecole di ATP) alla fosforilazione ossidativa mitocondriale (che genera 38 molecole di ATP) per soddisfare il loro fabbisogno energetico. La glicolisi aerobica è un processo inefficiente dal punto di vista energetico, per cui le cellule tumorali devono aumentare il consumo di glucosio di diverse volte.
Le cellule tumorali aumentano l’assorbimento del glucosio attraverso l’upregolazione di GLUT1, una proteina di membrana che facilita l’assorbimento basale del glucosio. Il trattamento con FBZ determina una riduzione dell’assorbimento di glucosio nelle cellule tumorali a causa della downregulation dei trasportatori GLUT e di altri enzimi glicolitici chiave come l’esochinasi II (HKII).
Al fine di guidare la glicolisi aerobica, molti enzimi glicolitici sono upregolati durante la tumorigenesi. L’esochinasi II (HKII), un enzima glicolitico chiave, svolge un ruolo critico nella ritenzione e nel metabolismo del glucosio, fosforilando il glucosio a glucosio-6-fosfato, che può quindi entrare nella glicolisi.
L’HKII è quindi un enzima altamente vantaggioso per la sopravvivenza e la proliferazione delle cellule tumorali. L’FBZ compromette la funzione enzimatica dell’HKII nelle cellule tumorali, determinando una ridotta ritenzione di glucosio nelle cellule trattate con FBZ; alla fine le cellule tumorali muoiono perché non possono utilizzare il glucosio come fonte di energia attraverso la glicolisi aerobica.11
Superare La Programmazione Metabolica Nel Cancro Con Fenbendazolo, DCA E 2-DG
ii. DCA – inibisce la piruvato deidrogenasi chinasi (PDK)
Dicloroacetato di sodio (DCA), una piccola molecola già utilizzata per il trattamento dell’acidosi lattica acuta e cronica, è stato ampiamente riproposto come farmaco antitumorale.12,13
Le cellule tumorali traggono energia da un eccesso di glicolisi anziché dalla fosforilazione ossidativa mitocondriale. Regolando la glicolisi aerobica e aumentando l’acidità del microambiente tumorale, le cellule tumorali hanno un chiaro vantaggio. L’acidosi metabolica nel microambiente tumorale inibisce l’apoptosi o i meccanismi naturali di morte cellulare e contribuisce a creare una resistenza ai farmaci.
Durante la carcinogenesi, la maggior parte degli enzimi glicolitici viene upregolata, mentre gli enzimi che aiutano la fosforilazione ossidativa nei mitocondri vengono preferibilmente downregolati. La piruvato deidrogenasi chinasi (PDK) è un enzima che regola il flusso di glucosio nei mitocondri, sede della fosforilazione ossidativa. In presenza di PDK attivata, la piruvato deidrogenasi (PDH), un enzima pro-fosforilazione ossidativa, viene inibita, limitando l’ingresso del piruvato nei mitocondri, dove può avvenire l’ossidazione del glucosio.
Questo sposta il metabolismo verso la glicolisi. Il DCA colpisce selettivamente le cellule tumorali spostando il loro metabolismo dalla glicolisi alla fosforilazione ossidativa attraverso l’inibizione della piruvato deidrogenasi chinasi (PDK), l’inibitore della piruvato deidrogenasi (PDH).
L’attivazione degli enzimi PDH favorisce la fosforilazione ossidativa invece della glicolisi aerobica, la via preferita attraverso la quale le cellule tumorali soddisfano questo elevato fabbisogno energetico, interrompendo così il vantaggio metabolico delle cellule tumorali e rendendole più sensibili ai farmaci chemioterapici.
iii. 2-DG – un analogo o “mimico” del glucosio che blocca enzimi chiave come l’esochinasi e la glucosio-6-fosfato isomerasi.
2-deoxy-D-glucose (2-DG) è un analogo naturale del glucosio, non metabolizzabile, il cui gruppo 2-idrossile è sostituito da idrogeno. Il 2DG inibisce in modo competitivo l’assorbimento del glucosio perché il glucosio e il 2-DG sono entrambi trasportati all’interno della cellula dall’enzima di trasporto del glucosio (GLUT1). 14,15,16
Quando la quantità di glucosio trasportata all’interno della cellula tumorale è minore, la glicolisi aerobica può essere ridotta. La riduzione della glicolisi finisce per bloccare la proliferazione attiva delle cellule tumorali.
In secondo luogo, dopo l’ingresso nella cellula, l’esochinasi fosforila sia il glucosio che il 2DG per formare rispettivamente glucosio-6-fosfato e 2-Deossi-D-glucosio-6-fosfato (2DG-6-P).
Il 2DG-6-P non può essere ulteriormente metabolizzato attraverso la glicolisi. Come tale, agisce inibendo in modo competitivo la produzione di glucosio-6-fosfato dal glucosio durante la glicolisi, inibendo così il metabolismo del glucosio nelle cellule tumorali.
b) Come i 3 farmaci abbiano meccanismi unici, indipendenti e sinergici per indurre un’apoptosi selettiva nelle cellule tumorali, ma non in quelle normali
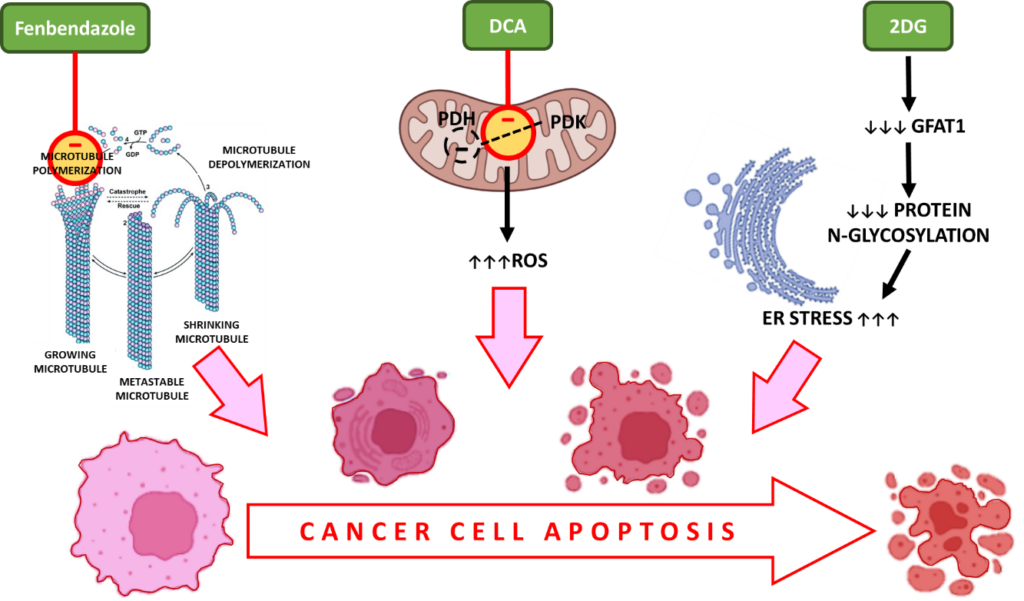
i. Fenbendazolo – interagisce con la β-tubulina impedendone la polimerizzazione per formare i microtubuli e provocando l’arresto del ciclo cellulare e la morte apoptotica delle cellule
Durante la divisione cellulare, i microtubuli, costituiti da subunità di tubulina, formano i fusi per consentire la corretta segregazione cromosomica. FBZ interrompe la polimerizzazione della tubulina, un passaggio essenziale durante la proliferazione cellulare, garantendo l’arresto del ciclo cellulare nelle cellule tumorali in attiva divisione.
Che si tratti di inibire l’aumento dell’assorbimento di glucosio o di colpire i microtubuli per arrestare la divisione cellulare incontrollata, le FBZ innescano l’apoptosi delle cellule tumorali come risultato finale comune.
ii. DCA – aumenta le specie reattive dell’ossigeno (ROS) nelle cellule tumorali, lo stress ossidativo, l’attivazione delle caspasi e l’apoptosi.
Il dicloroacetato (DCA) è un inibitore della piruvato deidrogenasi chinasi (PDK) che fosforila la PDH in fosfo PDH, il substrato attivo della glicolisi aerobica.13
L’inibizione della PDK e l’attivazione della PDH sono associate a una maggiore produzione di specie reattive dell’ossigeno (ROS). I ROS inducono rotture a doppio filamento nel DNA delle cellule tumorali e aumentano la loro sensibilità alla radioterapia e all’apoptosi.
iii. 2-DG – priva le cellule tumorali di sostanze nutritive, provoca stress ossidativo e morte cellulare apoptotica
Poiché il 2DG imita le condizioni di privazione di glucosio, inibisce la glicolisi aerobica, che in ultima analisi porta alla privazione di nutrienti e alla morte cellulare.
Inoltre, GFAT1 è un gene che svolge un ruolo importante nella glicosilazione delle proteine ed è essenziale per il metabolismo delle cellule tumorali. La somministrazione di 2DG riduce il GFAT1 in modo dose-dipendente, provocando un’interruzione della N-glicosilazione delle proteine. Questo provoca la morte cellulare delle cellule tumorali indotta dallo stress ER
Induzione Dell’apoptosi Nel Cancro Con Fenbendazolo, DCA E 2-DG
c) Come i 3 farmaci integrano i trattamenti oncologici standard per esercitare ulteriori effetti sinergici
i. Fenbendazolo – basso profilo di effetti collaterali, quindi facile da co-somministrare con i trattamenti tradizionali e ottenere effetti sinergici
Un altro aspetto importante della FBZ è il suo elevato margine di sicurezza, la bassa tossicità e la minima resistenza ai farmaci rispetto ad altri agenti chemioterapici come i taxani e gli alcaloidi della vinca che, pur interrompendo la polimerizzazione della tubulina e arrestando la divisione cellulare, causano una tossicità acuta nell’uomo.
Inoltre, la FBZ dimostra anche una riduzione della formazione di nuovi vasi sanguigni attraverso l’angiogenesi e l’inibizione della crescita tumorale nelle cellule del cancro al polmone.
ii. DCA – Inverte la resistenza alla chemioterapia e alla radioterapia.
Il trattamento con DCA inibisce la piruvato deidrogenasi chinasi (PDK). La diminuzione della fosforilazione della PDH da parte della PDK riduce la piruvato deidrogenasi fosforilata (pPDH), abbassa la glicolisi aerobica, la produzione di lattato e il tasso di acidificazione extracellulare (ECAR).
Interrompendo la glicolisi aerobica, il DCA rende le cellule tumorali più sensibili ai farmaci chemioterapici, mentre l’aumento dei ROS conferisce alle cellule tumorali una maggiore sensibilità alle radiazioni. Uno studio condotto su cellule di cancro al polmone e al fegato ha dimostrato che la somministrazione congiunta di DCA e paclitaxel, un agente chemioterapico, aumenta la morte cellulare apoptotica nelle cellule tumorali.
iii. 2-DG – rallenta le cellule tumorali metabolicamente iperattive e le rende più vulnerabili ai trattamenti tradizionali
Il 2DG è anche noto per indurre l’espressione della proteina interagente con la tioredoxina (TXNIP), che è una proteina soppressore del tumore. In questo modo aumenta la chemiosensibilità e la sensibilità alle radiazioni delle cellule tumorali.
Ciò a sua volta determina un aumento della morte cellulare apoptotica in risposta a questi trattamenti convenzionali. Per questo motivo, il 2-DG agisce come sensibilizzatore della chemioterapia e della radioterapia nelle cellule tumorali.
Lotta Al Cancro Con Fenbendazolo, DCA E 2-DG Per Superare La Riprogrammazione Metabolica
Il paradigma attualmente prevalente per il trattamento del cancro dipende in larga misura da chirurgia, radioterapia e chemioterapia. Questo approccio combinato, tradizionalmente utilizzato, ha avuto successo nel contrastare la progressione del cancro in molti casi e in alcuni casi è stato addirittura in grado di curare efficacemente i pazienti.
Tuttavia, per i pazienti diagnosticati in uno stadio avanzato e/o metastatico della malattia, o per quelli che sfortunatamente progrediscono verso uno stadio avanzato e/o metastatico della malattia, l’approccio combinato di cui sopra si è rivelato ampiamente inefficace.Il motivo è che le cellule tumorali, di fronte alla morte imminente dovuta alla pressione terapeutica, possono spesso adattarsi attraverso un processo chiamato riprogrammazione metabolica, in cui imparano a utilizzare in modo differenziato le tipiche fonti di energia cellulare, come il glucosio, in modo da diventare resistenti alla chemioterapia.
Finché questo adattamento metabolico non sarà preso di mira, i trattamenti rimarranno in gran parte inefficaci per i tumori avanzati e/o metastatici.Fortunatamente esistono già farmaci sicuri ed efficaci per superare la riprogrammazione metabolica e sono attualmente disponibili per i pazienti oncologici. Tre di questi farmaci sono il fenbendazolo, il DCA e il 2-DG, che agiscono singolarmente attraverso una serie di meccanismi.
Se usati in combinazione, spesso esercitano effetti sinergici e possono essere ancora più efficaci che se usati singolarmente. Inoltre, il loro utilizzo non preclude l’impiego di trattamenti standard come la chemioterapia o la radioterapia.
Sulla base dei dati disponibili, si prevede che la somministrazione di Fenbendazolo, DCA e/o 2-DG in associazione ai trattamenti tradizionali possa migliorare l’efficacia complessiva del trattamento del cancro, soprattutto in fase avanzata e/o metastatica.
Prospettive Future
Sebbene siano in corso studi e sperimentazioni cliniche per comprendere meglio come questi 3 farmaci possano essere ulteriormente utilizzati per ottenere benefici terapeutici, essi sono attualmente disponibili per i pazienti da combinare in regimi di trattamento.
Riferimenti:
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
- Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer. Nature. 2019 Nov;575(7782):299-309. doi: 10.1038/s41586-019-1730-1. Epub 2019 Nov 13. PMID: 31723286; PMCID: PMC8008476.
- Bukowski K, Kciuk M, Kontek R. Mechanisms of Multidrug Resistance in Cancer Chemotherapy. Int J Mol Sci. 2020 May 2;21(9):3233. doi: 10.3390/ijms21093233. PMID: 32370233; PMCID: PMC7247559.
- Nong S, Han X, Xiang Y, Qian Y, Wei Y, Zhang T, Tian K, Shen K, Yang J, Ma X. Metabolic reprogramming in cancer: Mechanisms and therapeutics. MedComm (2020). 2023 Mar 27;4(2):e218. doi: 10.1002/mco2.218. PMID: 36994237; PMCID: PMC10041388.
- Vaupel P, Multhoff G. Revisiting the Warburg effect: historical dogma versus current understanding. J Physiol. 2021 Mar;599(6):1745-1757. doi: 10.1113/JP278810. Epub 2021 Jan 4. PMID: 33347611.
- Batch JT, Lamsal SP, Adkins M, Sultan S, Ramirez MN. Advantages and Disadvantages of the Ketogenic Diet: A Review Article. Cureus. 2020 Aug 10;12(8):e9639. doi: 10.7759/cureus.9639. PMID: 32923239; PMCID: PMC7480775.
- Fu L, Jin W, Zhang J, Zhu L, Lu J, Zhen Y, Zhang L, Ouyang L, Liu B, Yu H. Repurposing non-oncology small-molecule drugs to improve cancer therapy: Current situation and future directions. Acta Pharm Sin B. 2022 Feb;12(2):532-557. doi: 10.1016/j.apsb.2021.09.006. Epub 2021 Sep 10. PMID: 35256933; PMCID: PMC8897051.
- Dogra N, Kumar A, Mukhopadhyay T. Fenbendazole acts as a moderate microtubule destabilizing agent and causes cancer cell death by modulating multiple cellular pathways. Sci Rep. 2018 Aug 9;8(1):11926. doi: 10.1038/s41598-018-30158-6. PMID: 30093705; PMCID: PMC6085345.
- Park D, Lee JH, Yoon SP. Anti-cancer effects of fenbendazole on 5-fluorouracil-resistant colorectal cancer cells. Korean J Physiol Pharmacol. 2022 Sep 1;26(5):377-387. doi: 10.4196/kjpp.2022.26.5.377. PMID: 36039738; PMCID: PMC9437363.
- Song B, Park EY, Kim KJ, Ki SH. Repurposing of Benzimidazole Anthelmintic Drugs as Cancer Therapeutics. Cancers (Basel). 2022 Sep 22;14(19):4601. doi: 10.3390/cancers14194601. PMID: 36230527; PMCID: PMC9559625.
- Tataranni T, Piccoli C. Dichloroacetate (DCA) and Cancer: An Overview towards Clinical Applications. Oxid Med Cell Longev. 2019 Nov 14;2019:8201079. doi: 10.1155/2019/8201079. PMID: 31827705; PMCID: PMC6885244.
- Parczyk J, Ruhnau J, Pelz C, Schilling M, Wu H, Piaskowski NN, Eickholt B, Kühn H, Danker K, Klein A. Dichloroacetate and PX-478 exhibit strong synergistic effects in a various number of cancer cell lines. BMC Cancer. 2021 Apr 30;21(1):481. doi: 10.1186/s12885-021-08186-9. PMID: 33931028; PMCID: PMC8086110.
- O’Neill S, Porter RK, McNamee N, Martinez VG, O’Driscoll L. 2-Deoxy-D-Glucose inhibits aggressive triple-negative breast cancer cells by targeting glycolysis and the cancer stem cell phenotype. Sci Rep. 2019 Mar 7;9(1):3788. doi: 10.1038/s41598-019-39789-9. PMID: 30846710; PMCID: PMC6405919.
- Pajak B, Siwiak E, Sołtyka M, Priebe A, Zieliński R, Fokt I, Ziemniak M, Jaśkiewicz A, Borowski R, Domoradzki T, Priebe W. 2-Deoxy-d-Glucose and Its Analogs: From Diagnostic to Therapeutic Agents. Int J Mol Sci. 2019 Dec 29;21(1):234. doi: 10.3390/ijms21010234. PMID: 31905745; PMCID: PMC6982256.
- Zhang D, Li J, Wang F, Hu J, Wang S, Sun Y. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014 Dec 28;355(2):176-83. doi: 10.1016/j.canlet.2014.09.003. Epub 2014 Sep 10. PMID: 25218591.